Devoirs Corrigés Physique N°2 S1 2AC
Modèle $N°1$
Durée : 1 heure
Exercice 1
8 points
1 – Complète les phrases ci-dessous par les mots convenables de la liste suivante : 4 points
l’incendie – comburant – produits – Combustion – l’asphyxie – réactifs – combustible
– L’expérience dans laquelle une substance brûle est appelée
– Le corps qui brûle est le
– Le corps qui permet la combustion est le
– Au cours d’une ,
– les substances qui disparaissent sont les ,
– les substances qui se forment sont les ,
– si la combustion se propage à d’autres objets; il faut donc éloigner des flammes toute matière combustible si le dioxygène de l’air est consommé par la combustion ; il faut donc éviter de boucher les ventilations.
2 – Souligne la bonne réponse parmi les propositions entre parenthèses : 4 points
a – On dit que la combustion est (incomplète/complète) il se forme du carbone et monoxyde de carbone,
b – Lorsque la flamme est (jaune / bleue) il ne se forme que du dioxyde de carbone et de l’eau.
c – Lors d’une réaction chimique, les atomes se réarrangent, mais (ne disparaissent pas / disparaissent)
d – Lors d’une transformation physique, les substances ne font que changer de (forme / Volume) ou d’état physique.
Exercice 2
8 points
On réalise la combustion du carbone dans le dioxygène :
1) Quel(s) est (sont) le(s) réactif(s) ? 1 point
2) Quel(s) est (sont) le(s) produit(s) ? 0.5 point
3) Lors de l’expérience, schématisez (avec une légende) le test qui t’a permis de trouver le produit de la réaction. 2 points
Trouble de l’eau de chaux – Flacon où il y a eu réaction – l’eau de chaux
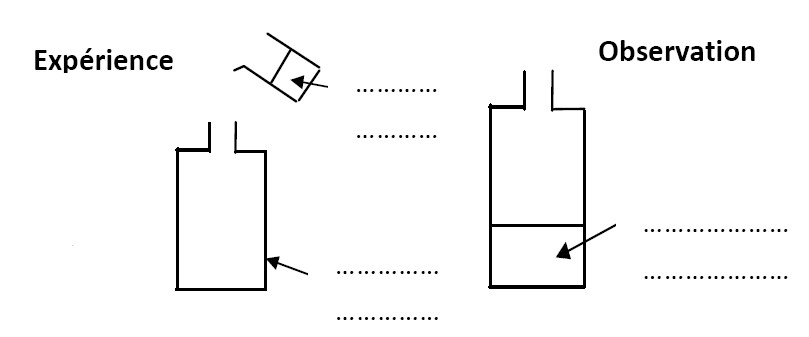
4) Représentez cette réaction chimique comme on l’a vu en cours. (Écriture bilan) 1 point
5) Écrire l’équation bilan 1 point
6) On fait brûler un morceau de charbon dans un flacon de dioxygène. La combustion est interrompue alors que le charbon n’a pas brûlé complètement. Expliquez pourquoi : 1 point
7) Complète la phrase ci-dessous par les mots convenables 1.5 point
– Au cours de la combustion du charbon, du et du ont disparus et du est apparu.
Exercice 3
4 points
Quand Hamza alluma le briquet, il remarqua que la flamme était jaune et brillante et que de la fumée noire montait avec lui.
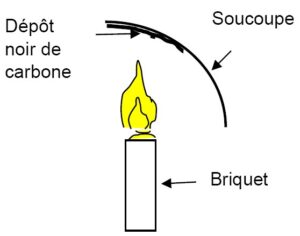
1. Expliquez à Hamza la cause de l’apparition d’une flamme jaune. 1 point
2. Déterminez la nature de la fumée noire qui monte ? 1 point
3. Identifiez les produits de cette combustion ? 2 points
Modèle $N°2$
Durée : 1 heure
EXERCICE 1
8.5 points
1) Cocher la bonne réponse. Pour chaque question, une seule réponse est valable. 3 points
Au cours d’une combustion, le dioxygène est:
Le combustible.
Le comburant.
L’air.
L’eau de chaux montre l’existence de
Le dioxyde de carbone.
Le butane.
Le carbone.
L’air qui constitue l’atmosphère est un :
Corps pur
mélange
corps pur composé
La dimension de l’atome est à l’ordre de :
1 nm
1 cm
1 m
2) Répondre par : vrai ou faux 3 points
On peut observer l’atome à l’œil nu.
Un corps pur simple est constitué par des atomes identiques.
On modélise les atomes par des sphères de couleur et taille différente.
Au cours de la combustion incomplète se produisent 4 corps différents.
3) Remplir les vides par l’expression convenable. 2.5 points
flamme bleu ; molécule ; indivisible ; différents , ouverte
– Un atome est la plus petite particule de matière.
– Une est un regroupement de plusieurs atomes identiques ou liés entre eux.
– Quand la virole est , il y a assez de dioxygène. Le butane brûle avec une non éclairante. On dit que la combustion complète.
EXERCICE 2
7 points
Au cours de la combustion du méthane dans une quantité importante de dioxygène, il y a l’apparition de dioxyde du carbone et l’eau :
1. Est-ce que la combustion complète ou incomplète ? Justifier votre réponse : 1 point
Justification 1 point
2. Quelles sont les deux corps existants avant la transformation ? 1 point
3. Quelles sont les deux corps existants après la transformation ? 1 point
4. Ecrire l’expression de la transformation chimique. 1.5 point
5. Modéliser la transformation par le modèle moléculaire. 1.5 point
6. Quel est le test qui met en évidence l’existence de gaz de dioxyde de carbone ? 1 point
EXERCICE 3
3.5 points
Sur un article, tu as trouvé les compositions de l’air comme montre le tableau :
| Composition | % |
|---|---|
| N₂ | 78% |
| O₂ | 21% |
| Ar | 0,93% |
| CO₂ | 0,04% |
| Ne | 0,0018% |
| CH₄ | 0,000172% |
1. Mets les compositions de l’air dans le cas convenable. 2.5 points
| L’atome | La molécule | La molécule |
| Simple | Composée | |
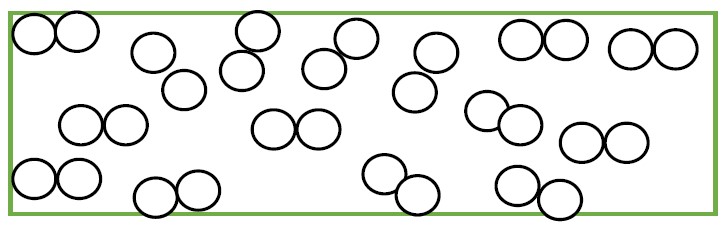
2. On considère que l’air ne contient que 80% de diazote et 20% dioxygène, combien de molécule de dioxygène existe dans le cadre ? Colorer les en rouge. 1 point
Modèle $N°3$
Durée : 1 heure
Exercice 1
5.2 points
1- Compléter les phrases ci-dessous par les mots convenables de la liste suivante :
produits – butane – chimique – dioxygène – réactifs
□ Au cours de la combustion du butane, le est le comburant et le est le combustible.
□ Une réaction chimique est une transformation au cours de laquelle des corps sont consommés appelés et d’autres corps sont formés appelés .
2- Relier par des flèches :
Colonne A
• Combustion complète
• Combustion incomplète
Colonne B
• Virole fermée
• Flamme jaune
• Virole ouverte
• Flamme bleue
Espace pour tracer les flèches de correspondance
3- Citer 2 dangers des combustions.
4- Equilibrer les équations chimiques suivantes :
SO₂ + O₂ → SO₃
C + O₂ → CO
N₂ + H₂ → NH₃
C₂H₆ + O₂ → CO₂ + H₂O
Exercice 2
8 points
A) On réalise la combustion complète d’éthane contenu dans un briquet.
1- Quel est le combustible ? le comburant ? 1 point
– –
2- Quels sont les réactifs de cette combustion ? 1 point
3- Quels sont les produits de cette combustion ? 1 point
4- Ecrire le bilan de cette combustion ? 1 point
B) Lorsqu’on brûle 44g de propane (C₃H₈) dans du dioxygène, il se forme 132g de dioxyde de carbone et 72g d’eau.
1- Ecrire l’équation bilan de cette réaction ? 2 points
2- Quelle est la masse de dioxygène consommée au cours de cette transformation ? 2 points
Exercice 3
6.8 points
Pour préparer son diner, Amine place une casserole sur la flamme de couleur jaune d’une cuisinière alimentée par le gaz naturel butane. La casserole noircit très vite.

1- Quel est le produit formé responsable du dépôt noir sur la casserole ? 1 point
2- La combustion du butane est-elle complète ou incomplète ? Justifier votre réponse. 2 points
3- Le brûleur est donc mal réglé. Faut-il augmenter ou réduire le débit du butane ? 1 point
Modèle $N°4$
Durée : 1 heure
Exercice 1
1) Sur le schéma a, le fusain en carbone brûle ; sur le schéma b, la combustion est terminée. Observer ces 2 schémas et dire parmi les affirmations suivantes lesquelles sont vraies ou fausses.
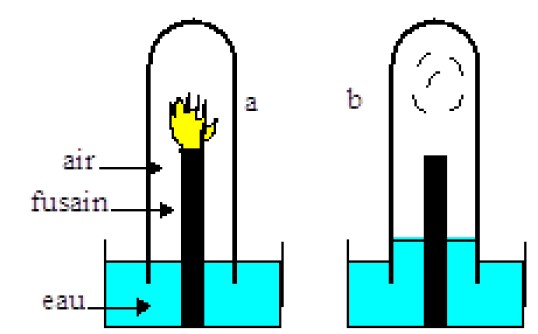
❖ La combustion est terminée car il n’y a plus de dioxygène:
❖ La combustion est terminée car le fusain s’éteint:
❖ L’eau est montée dans le tube car l’air s’est dissout:
❖ Le dioxygène a été remplacé par du dioxyde d’azote:
❖ Le dioxygène a disparu, il ne reste que de l’azote:
❖ Le test de reconnaissance de dioxyde de carbone est le troublement de l’eau de sucre:
2) Donnez le bilan de la combustion de carbone :
| Avant la combustion | Après la combustion | |
| Le combustible | Le comburant | Le produit |
3) Classer les transformations suivantes en transformations physiques et transformations chimiques :
condensation – combustion de carbone – réaction de fer et soufre – sublimation
| Transformations physiques | Transformations chimiques |
4) Citer deux dangers de la combustion :
Exercice 2
I. Le pentane (C₅H₁₂) réagit avec une quantité suffisante de dioxygène (O₂) pour donner du dioxyde de carbone (CO₂) et de l’eau (H₂O).
1- La combustion du pentane est une combustion complète ou combustion incomplète :
2- Quels sont les réactifs de la réaction ?
3- Quels sont les produits de la réaction ?
4- Ecrire le bilan de la réaction :
…………………. + …………………. → …………………. + ………………….
II. « Que se passe-t-il quand on fait brûler du méthane dans un endroit très pauvre en dioxygène ? ».
Pour cela, on dispose de tout le matériel nécessaire.
1- Que veut dire l’expression « un endroit très pauvre en dioxygène » ?
2- Quelle combustion peut-on réaliser ? Répondre avec précision
3- Donner la liste du matériel nécessaire pour réaliser l’expérience ?
4- Remplir le tableau suivant :
| Avant la combustion | Après la combustion | |
Le combustible | Le comburant | Les produits |
5- Donnez le bilan de cette réaction :
Exercice 3
Le brûleur d’une cuisinière à gaz consomme 50 ml de butane à la seconde. La combustion complète d’un litre de gaz butane consomme le dioxygène contenu dans 40 litres d’air en formant 5 litres de dioxyde de carbone et 6 litres de vapeur d’eau.
1- Rappeler les 2 principaux gaz de l’air et ses proportions :
2- Combien y a-t-il de litres de dioxygène dans 40 litres d’air ?
3- Combien de litres d’air sont nécessaires pour faire fonctionner cette cuisinière durant une heure ?
4- Sachant que cette pièce contient 29 m³ d’air, quels gaz contient l’atmosphère de la pièce après une heure de fonctionnement de la cuisinière s’il n’existe aucune ventilation dans cette pièce ?
5- Pourquoi les murs et les vitres sont-ils embués ?
6- Quand un brûleur à gaz fonctionne dans une pièce appauvrie en dioxygène, la combustion est modifiée. Elle devient incomplète. Du monoxyde de carbone est produit à la place du dioxyde de carbone. Ce gaz est un toxique mortel qui empoisonne le sang. Résumez et justifiez les dangers qu’encourt une personne occupant une pièce dans laquelle un appareil à gaz butane fonctionne sans ventilation.
Modèle $N°5$
Durée : 1 heure
Exercice 1
8 points
1- Compléter les phrases suivantes :
✓ La réaction chimique est une au cours de laquelle, des corps disparaissent s’appellent et d’autres nouveaux corps apparaissent s’appellent .
✓ Au cours de la réaction chimique, la somme est égale à la somme des .
2- Répondre par vrai ou faux puis corriger l’erreur :
✓ La fusion est une réaction chimique
✓ Toutes les réactions chimiques sont des combustions
✓ La réaction d’oxyde de cuivre II avec le carbone est une combustion
3- Lier par une flèche :
Colonne A
a- Gaz trouble l’eau de chaux
b- Dépôt noir
c- Gaz liquéfié sur la paroi d’un récipient froid
d- Un gaz toxique résulte d’une combustion incomplète
Colonne B
1- Monoxyde de carbone
2- Dioxyde de carbone
3- Carbone
4- Vapeur d’eau
4- Compléter les réactions chimiques suivantes :
Alcool + → +
+ → sulfure de fer
Exercice 2
8 points
Partie A
Lors de la combustion du 30g de gaz butane dans une quantité suffisante de dioxygène, se produit 41g de dioxyde de carbone et de 15 g de vapeur d’eau
1- La combustion du butane dans ce cas est-elle complète ou incomplète? Justifiez votre réponse?
2- Déterminer :
Les réactifs :
Les Produits :
3- Donner l’expression écrite de cette réaction ?
4- Écrire l’équation de cette réaction ?
5- Calculer la masse m(O₂) de dioxygène disparaît ?
Partie B
La combustion du soufre S dans le dioxygène O₂ produit un gaz toxique, appelé dioxyde de soufre SO₂
1- Déterminer :
a- le combustible :
b- le comburant :
c- le produit :
2- Écrire l’équation de cette réaction ?
3- Pour obtenir la quantité de dioxyde de soufre de 6g, nous brûlons 5g du soufre dans 3g de dioxygène. Calculer la masse de soufre restée à la fin de la réaction?
Exercice 3
4 points
Lorsque Fahd a allumé le bec Bunsen, il remarquait une flamme jaune et fumée noire
1- Expliquer la cause de la flamme jaune et déterminez la nature de la fumée noire ?
2- Identifier les produits de cette combustion ?
3- Aider Fahd à proposer une méthode lui permettant d’obtenir une flamme bleue sans fumée ?
Devoirs Corrigés Physique N°2 S1 2AC
