La concentration et les solutions électrolytiques - Cours
La concentration et les solutions électrolytiques
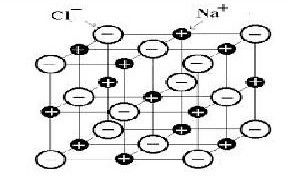
1-Solide ionique
Un solide ionique est un solide composés d’ions. Etant donné qu’un tel solide est toujours électriquement neutre il associe toujours des cations et des anions dont les charges se compensent.
Exemple : – La formule NaCl indique que le chlorure de sodium comporte autant d’ions sodium que d’ions chlorure. En effet chaque ion ne porte qu’une charge, une charge positive pour Na+ et une négative pour Cl- .
2-Molécule polaire
Une molécule est un ensemble d’atomes (au moins deux) identiques ou non, unis les uns aux autres par le biais de liaisons chimiques. Ces dernières sont les résultats de la mise en commun d’un certain nombre d’électrons
gravitant sur la couche externe des atomes.
La liaison dite covalente simple lorsque deux atome mettent en commun un unique électron de leur couche externe chacun.
Dans une liaison, le doublet électronique peut ne pas être partagé équitablement entre les deux atomes : l’un
des deux atomes peut avoir une force d’attraction sur le nuage électronique plus grande que l’autre.
On appelle électronégativité cette capacité pour les atomes à attirer le nuage électronique. Ce partage inéquitable de la charge électronique transforme alors le couple atomique en dipôle. Tout se passe alors comme s’il y avait un transfert électronique partiel de l’atome le moins électronégatif vers l’atome le plus électronégatif lorsque la différence d’électronégativité est très faible, voire nulle, les charges partielles sont nulles (δe=0) et la liaison est complètement apolaire : le doublet électronique est réparti équitablement entre les atomes, la liaison est dite covalente.
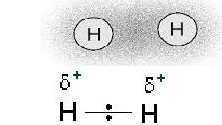
Si deux atomes impliqués dans une liaison de covalence sont d’électronégativités
différentes, la répartition des charges est dissymétrique : les électrons de la liaison sont délocalisés vers l’atome le plus électronégatif, qui porte alors une charge partielle négative notée δ- . L’autre atome de la liaison porte, quant à lui, une charge partielle positive notée δ+ .
Plus les charges sont réparties de façon asymétrique, plus une liaison ou molécule
sera polaire la liaison perd alors de son caractère covalent pour tendre vers une
liaison ionique pur. Ces liaisons est dites polarisées.
















