Les atomes et les ions exercices corrigés
Matériaux et électricité
I. L’atome : un modèle pour comprendre (structure de l’atome)
1. Modèles d’atome
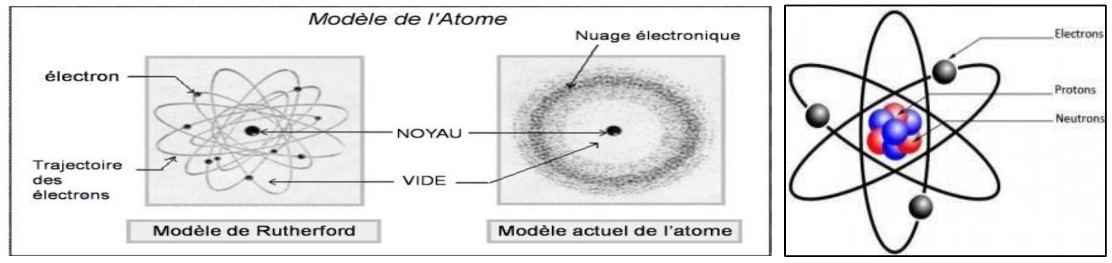
– Modèle de BOHR c’est le modèle planétaire les électrons gravitent sur des trajectoires précises.
– Le modèle actuel modélise l’atome par: le noyau qui est entouré d’un nuage électronique (pas de trajectoire) ; c’est le modèle de Scrodinger, modèle probabiliste
– L’atome est constitué d’un noyau entouré d’électrons formant un nuage électronique.
a. Le noyau :
– Le noyau est situé au centre de l’atome et porte des charges positives.
– Toute la masse de l’atome est pratiquement concentrée dans le noyau.
– Le diamètre du noyau est $100000$ fois plus petit que celui de l’atome : l’atome est formé essentiellement du vide : L’atome a une structure lacunaire.
– Le nombre de charges positives du noyau d’un atome est appelé numéro atomique noté $Z $, c’est une caractéristique de l’atome.
b. Les électrons :
– Les électrons tournent autour du noyau à très grande vitesse sur des trajectoires variables, plus ou moins éloignées du noyau. Ils forment un cortège électronique dans un atome.
– La masse des électrons est très faible : $\mathrm{m_{e}}=9,1 \cdot \mathrm{10}^{-31} \mathrm{~kg}$
– Chaque électron porte une charge électrique négative notée – e, qui représente la charge élémentaire, exprimée en coulomb de symbole C , sa valeur est $e=1,6 \times \mathrm{10}^{-19} \mathrm{C}$.
– On symbolise l’électron par ${e}^{-}$
– Les électrons sont identiques quel que soit l’atome.
– Chaque atome a un nombre défini d’électrons.
2. Symbole et nombre d’électrons de quelques atomes:
$\begin{array} {|r|r|}\hline atome & symbole & Nombre \quad d’électrons \\ \hline hydrogène & H & 1 \\ \hline carbone & C & 6 \\ \hline oxygène & O & 8 \\ \hline cuivre & Cu & 29 \\ \hline fer & Fe & 26 \\ \hline \end{array}$
3. Neutralité électronique de l’atome :
– Dans un atome le nombre de charges positives de son noyau est égal au nombre de charges négatives de ses électrons.
– Ainsi, la charge positive du noyau $( + Ze )$ est opposée à la charge négative du nuage électronique $( -Ze)$.
– La charge totale d’un atome est nulle $( +Ze )$ $+(-\mathrm{Ze})=0$ : l’atome est électriquement neutre.
$ \text { Charge de l’atome }=\text { charge du noyau }+ \text { charge du nuage électronique } $
$ 0=(+\mathrm{Ze})+(-\mathrm{Ze})$
Application :
$\begin{array} {|r|r|}\hline L’atome & symbole & \begin{array} NNuméro \\ atomique \quad Z \end{array} & \begin{array} CCharge \quad de \quad noyau \\ de \quad l’atome (+Ze) \end{array} & \begin{array} CCharge \quad des \quad électrons \\ de \quad l’atome (-Ze) \end{array} & Charge \quad d’atome \\ \hline Hydrogène & H & 1 & +1 e & -17 e & 0 e \\ \hline Carbone & C & 6 & +6 e & -6 e & 0 e \\ \hline Fer & Fe & 26 & +26 e & -26 e & 0 e \\ \hline Chlore & Cl & 17 & +17 e & -17 e & 0 e \\ \hline \end{array}$
II. Les ions

1. Définition:
– Un ion est un atome qui a perdu ou gagné un ou plusieurs électrons.
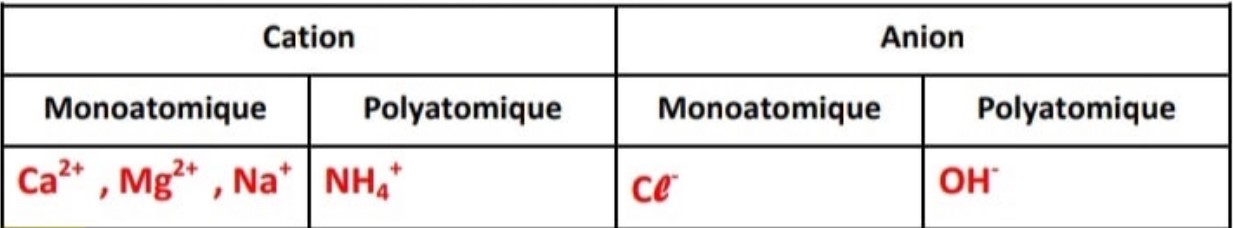
– Certains ions sont constitués d’un seul type d’atome. On les appelle des ions monoatomiques.
– D’autres sont formés par l’association d’atomes de types différents : ce sont des ions polyatomiques.
– Un atome ne peut perdre que des charges négatives.
– Le nombre de protons (charges positives) ne change pas.
– Un anion est un ion négatif. Il a gagné un ou plusieurs électrons.
– Un cation est un ion positif. Il a perdu un ou plusieurs électrons.
2. Les types d’un ion :
On distingue deux types d’ions :
• Les ions positifs appelés cations exemples: $\mathrm{H}^{+}, \mathrm{Cu}^{2+}, \mathrm{NH}^{4+}$
• Les ions négatifs appelés anions exemples: $\mathrm{OH}^{-}, \mathrm{S}^{2-}, \mathrm{HCOO}^{-}$
* Un anion est un atome ou un groupe d’atomes qui a gagné un ou plusieurs électrons.
* Un cation est un atome ou un groupe d’atomes qui perdu un ou plusieurs électrons.
Remarque :
\$ Un ion monoatomique est constitué d’un seul atome.
\$ Un ion poly atomique est constitué par un ensemble d’atomes.

3. formule des ions :
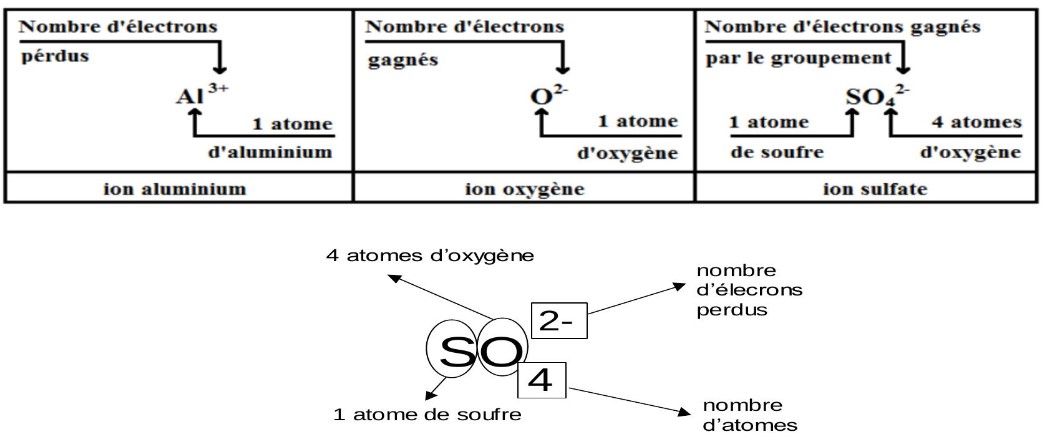
• On représente un ion monoatomique par le même symbole de l’atome en ajoutant en haut et à droite du symbole le nombre de charges et de leur signe ( + ou – ).
• La formule de l’ion poly atomique s’obtient en :
– écrivant la formule de la molécule qui serait formée par ces atomes
– indiquant en exposant le nombre de charges et le signe
• La formule d’un ion monoatomique s’écrit à partir du symbole de l’atome auquel on ajoute en haut et à droite le nombre de charges et de leur signe ( + ou – ).
Exercice 1:
Répond par vrai ou faux :
$1)$ Un cation est un atome ou un groupe d’atomes qui a gagné un ou plusieurs électrons.
$2)$ Un anion est un atome ou un groupe d’atomes qui perdu un ou plusieurs électrons.
$3)$ Un ion monoatomique est constitué d’un seul atome.
$4)$ Un ion poly atomique est constitué par un ensemble d’atomes.
$1)$ Faux
$2)$ Faux
$3)$ Vrai
$4)$ Vrai
Exercice 2:
Compléter les phrases par les mots : -e – noyau – $(-Ze)$ – nuage –positive – négative – $(+Ze)$ – nulle – numéro atomique – gagné – perdu
$1)$ L’atome est constitué d’un $………………..$entouré d’électrons formant un$………………….$électronique
$2)$ La charge de noyau d’un atome est $………………………….$et s’exprime en fonction de $e$ :$ …………………..$
$3)$ Chaque électron porte une charge $……………………….$noté$ ………..$
$4)$ La charge négative des électrons d’un atome s’exprime en fonction de $e$ : $…………….$
$5)$ La charge totale d’un atome est $…………$
$6)$ Le nombre de charges positives du noyau d’un atome est appelé $……………………..$numéro atomique noté $ Z$
$7)$ Un ion est un atome qui a $……………….$ou $…………$un ou plusieurs électrons
$1)$ L’atome est constitué d’un noyau entouré d’électrons formant un nuage électronique
$2)$ La charge de noyau d’un atome est positive et s’exprime en fonction de $e$ : $+Ze$
$3)$ Chaque électron porte une charge négative noté $e$
$4)$ La charge négative des électrons d’un atome s’exprime en fonction de $e$ : $-Ze$
$5)$ La charge totale d’un atome est nulle
$6)$ Le nombre de charges positives du noyau d’un atome est appelé numéro atomique noté $ Z$
$7)$ Un ion est un atome qui a gagné ou perdu un ou plusieurs électrons
Exercice 3:
Classer les ions suivants dans le tableau si dessous : NH4+ , Ca2+ , Cl– ,OH– , Na+ , Mg2+
Exercice 4:
Le noyau de l’atome de silicium $(Si)$ contient $14$ charges positives.
$1)$ Quel est le numéro atomique de l’atome de silicium ?
$2)$ Combien y a-t-il d’électrons dans l’atome de silicium ?
$1)$ $Z = 14$
$2)$ $14$ électrons . on peut l’écrire $(14 e)$
Exercice 5:
Je complète le tableau suivant:
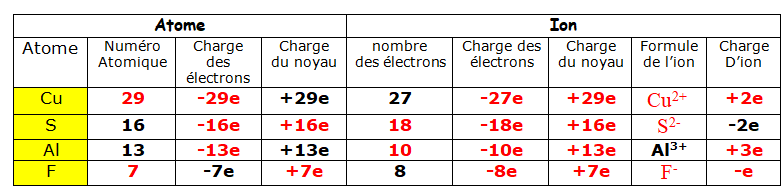
$\begin{array} {|r|r|}\hline Atome & Symbole & \begin{array} NNuméro \quad \\ atomique \quad Z \end{array} & \begin{array} CCharge \quad \\ d’électron \quad q_{e} \end{array} & \begin{array} CCharge \quad du \\ noyau \quad q_{n} \end{array} & \begin{array} CCharge \quad de \\ l’atome \quad q_{a} \end{array} \\ \hline & & & -8 e \quad \quad & & \\ \hline & & 13 \quad \quad & & & \\ \hline & Na \quad \quad & & & & \\ \hline & & & & +17 e \quad \quad & \\ \hline Cuivre & & & & & \\ \hline \end{array}$
$\begin{array} {|r|r|}\hline Atome & Symbole & \begin{array} NNuméro \quad \\ atomique \quad Z \end{array} & \begin{array} CCharge \quad \\ d’électron \quad q_{e} \end{array} & \begin{array} CCharge \quad du \\ noyau \quad q_{n} \end{array} & \begin{array} CCharge \quad de \\ l’atome \quad q_{a} \end{array} \\ \hline Oxygène & O & 8 & -8 e & +8 e & 0 \\ \hline Aluminium & Al & 13 & -13 e & +13e & 0 \\ \hline Sodium & Na & 11 & -11 e & +11e & 0 \\ \hline Chlore & Cl & 17 & -17 e & +17 e & 0 \\ \hline Cuivre & Cu & 29 & -29 e & +29 e & 0\\ \hline \end{array}$
Exercice 6:
$1)$ l’atome de zinc $(Zn)$ peut passer à l’état d’ion en perdant $2$ électrons. Quelle est la formule de l’ion correspondant ?
$2)$ l’atome de soufre $(S)$ peut passer à l’état d’ion en gagnant $2$ électrons. Quelle est la formule de l’ion correspondant ?
$1)$ l’atome de zinc $(Zn)$ perd $2$ électrons. Donc la formule de l’ion correspondant est : $\mathrm{Zn}^{2+}$
$2)$ l’atome de soufre $(S)$ gagne $2$ électrons. Donc la formule de l’ion correspondant est : $\mathrm{S}^{2-}$
Exercice 7:
L’atome du Zinc $(Zn)$ de numéro atomique $Z=30$ perd $2$ électrons pour devenir un ion.
$1)$ Combien d’électrons dans l’atome du zinc ?
$2)$ Déterminer la charge des électrons de cet atome en coulomb $(C)$.
$3)$ Déterminer la charge du noyau de cet atome en coulomb $(C)$.
$4)$ Déterminer la charge des électrons de l’ion du zinc en coulomb $(C)$.
$5)$ Déterminer la charge du noyau de l’ion du zinc en coulomb $(C)$.
$6)$ Calculer la charge d’ion du zinc en fonction de ‘e’ puis en coulomb $(C)$.
$7)$ Écrire la formule de l’ion.
$8)$ Donner le type de cetion.
$1)$ Il y a $30$ électrons dans l’atome du zinc.
$1)$ La charge des électrons de cet atome en coulomb (C) est :
On a: $q_{e}=-Z e=-30 e$
Alors: $q_{e}=-30 \times 1.6 \times 10^{-19} \mathrm{C}$
Donc: $q_{e}=-48 \times 10^{-19} \mathrm{C}$
$3)$ La charge du noyau de cet atome en coulomb (C) est:
On a: $q_{n}=+Z e=+30 e$
Alors: $q_{n}=+30 \times 1.6 \times 10^{-19} \mathrm{C}$
Donc: $q_{n}=+48 \times 10^{-19} \mathrm{C}$
$4)$ La charge des électrons de l’ion du zinc en coulomb (C) est :
L’atome du zinc perd 2 électrons et devient un ion, alors :
On a: $q_{e i}=-28 e$
Alors : $q_{e i}=-28 \times 1.6 \times 10^{-19} \mathrm{C}$
Donc: $q_{e}=-44.8 \times 10^{-19} \mathrm{C}$
$5)$ La charge du noyau de l’ion du zinc en coulomb (C) est :
On a: $q_{n i}=+30 e$
Alors: $q_{n i}=+30 \times 1.6 \times 10^{-19} \mathrm{C}$
Donc: $q_{n i}=+48 \times 10^{-19} \mathrm{C}$
$6)$ La charge de l’ion du zinc en fonction de ‘ $e$ ‘ est :
On a: $q_{i}=q_{e i}+q_{n i}$
$=-28 e+30 e$
Donc: $q_{i}=+2 e$
Où: $\quad q_{i}=+2 \times 1.6 \times 10^{-19} \mathrm{C}$
Donc: $q_{i}=+3.2 \times 10^{-19} \mathrm{C}$
$7)$ La formule de l’ion est: $\mathrm{Zn}^{2+}$.
$8)$ Le type de cet ion est : Cation monoatomique.
Exercice 8:
L’atome du cuivre (Cu) se transforme en ion Cu ${ }^{2+}$. (Z=29)
$1)$ Expliquer cette transformation.
$2)$ Donner la charge des électrons de l’ion $\mathbf{C u}^{\mathbf{2 +}}$ en fonction de la charge élémentaire $e$.
$3)$ Donner la charge du noyau de l’ion $\mathbf{C u}^{2+}$ en fonction de la charge élémentaire $e$.
$4)$ Calculer la charge de cet ion en coulomb $(C)$.
L’atome de soufre $(S)$ gagne $2$ électrons et devient un ion.
$1)$ Le numéro atomique $Z$ du soufre ( $S$ ) est : on a la charge des électrons de l’ion du soufre est : On a : $\boldsymbol{q}_{\boldsymbol{e i} \boldsymbol{i}}=$ -18 $e$, alors: $Z=16$.
$2)$ La formule de l’ion est : $S^{2-}$.
Le type de cet ion est : Anion monoatomique
$3)$ La charge de cet ion en coulomb C :
On a: $q_{e i}=-18 e$ et $q_{n i}=+16 e$
Alors: $q_{i}=q_{e i}+q_{n i}$
$=-18 e+16 e$
Donc: $q_{i}=-2 e$
$q_{i}=-2 \times 1.6 \times 10^{-19} C$
D’ou: $q_{i}=-3.2 \times 10^{-19} \mathrm{C}$
$4)$ La charge de l’atome du soufre est :
$\boldsymbol{q}_{\boldsymbol{n}}=\mathbf{0}$ car l’atome est électriquement neutre.
Exercice 9:
Considérons les ions suivants : $\mathrm{Cr}^{3+} ; \mathrm{CH}_{3} \mathrm{COO}^{-} ; \mathrm{SO}_{4}^{2-} ; \mathrm{H}_{3} \mathrm{O}^{+} ; \mathrm{Br}^{-} ; \mathrm{Mg}^{2+} ; \mathrm{NO}_{3}^{-}$.
$1)$ Classer ces ions suivants. (Anions/cations et ions monoatomiques/ions polyatomiques)
$2)$ La charge totale des électrons de l’ion $\boldsymbol{C r}^{\mathbf{3 +}}$ est : $\boldsymbol{q}_{\boldsymbol{e}}=-33.6 \times \mathbf{1 0}^{-\mathbf{1 9}} \mathrm{C}$.
$a)$ Trouver le numéro atomique de l’atome du chrome.
$b)$ Calculer en coulomb C la charge du noyau $\boldsymbol{q}_{\boldsymbol{n}}$ de cet atome.
$c)$ Calculer en coulomb C la charge des électrons $q_{e}$ de cet atome.
$d)$ Déduire $\boldsymbol{q}_{\boldsymbol{a}}$ la charge de l’atome.
$1)$ Je classe les ions: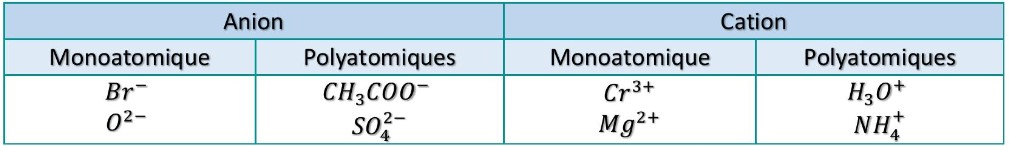
$2)$ La charge totale des électrons de l’ion $C r^{3+}$ est :
$\boldsymbol{q}_{\boldsymbol{e}}=-\mathbf{3 3 . 6} \times \mathbf{1 0}^{-\mathbf{1 9}} \mathbf{C}$.
$a)$ Le numéro atomique de l’atome du chrome.
On a : $q_{e}=\frac{-33.6 \times 10^{-19}}{1.6 \times 10^{-19}} \mathrm{e}$
Alors: $q_{e}=-21 e$
Et puisque cet atome a perdu 3 électrons, alors : $Z=21+3=24$
$b)$ La charge du noyau $q_{n}$ de cet atome en coulomb (c) est :
On a : $q_{n}=+Z e$
$=+24 e$
Alors: $q_{n}=+24 \times 1.6 \times 10^{-19} \mathrm{C}$
Donc: $q_{n}=+38.4 \times 10^{-19} \mathrm{C}$
$c)$ La charge des électrons $q_{e}$ de cet atome en coulomb (C) est :
On a: $q_{e}=-Z e$
$=-24 e$
Alors: $q_{e}=-24 \times 1.6 \times 10^{-19} \mathrm{C}$
Donc: $q_{e}=-38.4 \times 10^{-19} \mathrm{C}$
$d)$ La charge $q_{a}$ de l’atome est:
On a: $q_{a}=q_{e}+q_{n}$
$=-24 e+24 e$
Donc: $q_{i}=0$ on dit que l’atome est électriquement neutre.
Exercice 10:
$1)$ Le noyau de l’atome de calcium $(Ca)$ contient $20$ charges positives. On donne :
$a)$ Donner le numéro atomique $Z$ de l’atome de calcium.
$b)$ Déterminer en fonction de $(e)$ et en coulomb, $Q_{n}$ la charge de noyau de cet atome.
$c)$ Déterminer en fonction de $(e)$ et en coulomb, $Q_{e}$ la charge des électrons de cet atome.
$d)$ Calculer $Q_{a}$ la charge globale de l’atome.
$2)$ L’atome de calcium peut perdre deux électrons pour donner l’ion calcium.
$a)$ Ecrire la formule chimique de l’ion calcium et donner son type.
$b)$ Déterminer le nombre des électrons de l’ion calcium.
$c)$ Déterminer en fonction de $(e)$, $Q_{e}$ la charge des électrons de l’ion calcium.
$d)$ Calculer en fonction de $(e)$ la charge de l’ion calcium.
$1)$
$a)$ Le numéro atomique l’atome de calcium : $\mathrm{Z}=20$
$b)$ Déterminons la charge de noyau de cet atome :
– En fonction de la charge élémentaire (e) : $\mathrm{Q}_{\mathrm{n}}=+20 \mathrm{e}$
– En coulomb (c) : $\mathrm{Q}_{\mathrm{n}}=+20 \times 1,6.10^{-19} \mathrm{C}=+32.10^{-19} \mathrm{C}$
$c)$ Déterminons la charge des électrons de cet atome.
– En fonction de la charge élémentaire (e) : $\mathrm{Q}_{\mathrm{e}}=-20 \mathrm{e}$
– En coulomb (c) : $\mathrm{Q}_{\mathrm{e}}=-20 \times 1,6 \cdot 10^{-19} \mathrm{C}=-32 \cdot 10^{-19} \mathrm{C}$
$d)$ Calculons la charge globale de l’atome. :
$\mathrm{Qa}=\mathrm{Qn}+\mathrm{Qe}=+20 \mathrm{e}-20 \mathrm{e}=0$
$2)$
$a)$ la formule chimique de l’ion calcium : $\mathrm{Ca}^{2+} \quad$, son type : Cation
Le nombre d’électrons de l’ion calcium : $18$ électrons on peut l’écrire ( $18 \mathrm{e}^{-}$)
$c)$ la charge des électrons de l’ion calcium : $Q_{e}=-18 e$
$d)$ la charge de l’ion calcium :
$\mathrm{Qi}=\mathrm{Qn}+\mathrm{Qe}=+20 \mathrm{e}-18 \mathrm{e}=+2 \mathrm{e}$
Exercice 11:
L’atome de fer $(\mathrm{Fe})$ se transforme en ion $\mathrm{Fe}^{2+}$.
On donne $\mathrm{Z}(\mathrm{Fe})=26$ et $\mathrm{e}=1,6 \cdot {10}^{-19} \mathrm{C}$.
$1)$ Expliquer cette transformation
$2)$ Donner la charge des électrons d’ion $\mathrm{Fe}^{2+}$ en fonction de $e $
$3)$ Donner la charge du noyau d’ion $\mathrm{Fe}^{2+}$ en fonction de $e$
$4)$ Calculer la charge d’ion $\mathrm{Fe}^{2+}$ en coulomb $C$
$1)$ L’atome de fer $Fe$ se transforme en ion $\mathrm{Fe}^{2+}$ en perdant deux électrons.
$2)$ $ Q_{e}=-24 . \mathrm{e}$
$3)$ $Q_{n}=+26 . \mathrm{e}$
$4)$ $ Q_{i}=+2 . \mathrm{e}=+2 \times 1,6 \times 10^{-19} \mathrm{C}=+3,2 \times 10^{-19} \mathrm{C}$.
Exercice 12:
Le symbole d’un ion set: $\mathrm{NH}_{4}^{+}$
$1)$ Donner le type de ion
$2)$ Quelle est la charge d’ion $\mathrm{NH}_{4}^{+}$ en fonction de $e$
$3)$ Calculer la charge d’ion $\mathrm{NH}_{4}^{+}$ en coulomb $C$
$4)$ Calculer le nombre d’électrons d’ion
On donne : $Z(N)=7$ et $Z(H)=1$
$1)$ Un cation polyatomique.
$2)$ $Q_{i}^{\prime}=+1\mathrm{e}$
$3)$ $Q_{i}^{\prime}=+1 \times 1,6 \times 10^{-19} \mathrm{C}=+1,6 \times 10^{-19} \mathrm{C}$
$4)$ Un atome d’azote $(N)$ a $Z = 7$ protons → donc $7$ électrons à l’état neutre.
Chaque atome d’hydrogène (H) a 1 électron, donc $4 H = 4$ électrons.
Total sans charge : $7 (N) + 4 (H) = 11$ électrons
$\mathrm{NH}_{4}^{+}$ a perdu $1$ électron → Nombre total d’électrons $= 11 – 1 = 10$ électrons
Exercice 13:
Complétez le tableau suivant :
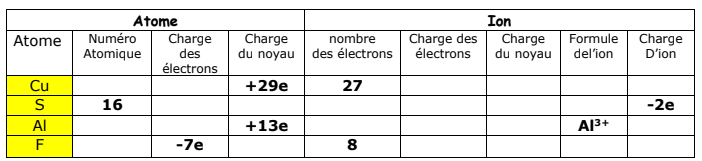
Les atomes et les ions exercices corrigés