Les lois de la réaction chimique exercices corrigés
Les lois de la réaction chimique
I. Notion de réaction chimique
1. Définitions
La réaction chimique est une transformation au cours de laquelle, des corps disparaissent(RÉACTIFS) et d’autres nouveaux corps apparaissent(PRODUITS).
Exemple : combustion de carbone
$1)$ Le bilan de la réaction de combustion : Lors de la combustion du carbone dans le dioxygène, il se forme du dioxyde de carbone
$\text { carbone } + \text { dioxygène } \rightarrow \text {dioxyde de carbone }$
$2)$ Explication de la combustion du carbone avec le modèle moléculaire :

$3)$ Équation bilan de la combustion de carbone :
$\mathrm{C} \quad+\quad \mathbf{O_{2}} \quad \rightarrow \quad \mathrm{CO_{2}}$

On écrit l’équation bilan de cette réaction en utilisant les symboles et les formules chimique de chaque substance.
Le nombre et le genre d’atome est conserve, il y a eu simplement un réarrangement des atomes entre eux.
Lois 1 : Au cours d’une réaction chimique, Le nombre et le genre d’atome est conservé
II. Conservation de la masse :
Expérience :
On fait tomber un morceau de craie dans l’acide chlorhydrique.
Observation :
L’effervescence indique un dégagement gazeux.
Le morceau de craie disparait. à la suite de cette réaction la masse de l’ensemble des réactifs et des produits n’a pas changé.
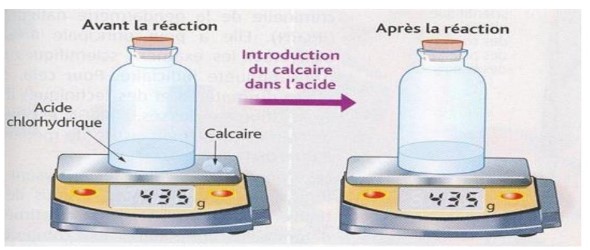
Conclusion : Loi 2 (Loi de Lavoisier) : Au cours d’une réaction chimique, la somme des masses des réactifs disparus est égale à la somme des masses desproduits formés.
Remarque : On est parfois amené à équilibrer l’équation bilan en ajoutant des coefficients stœchiométriques devant les symboles ou les formules chimiques pour que la règle de la conservation des atomes soit conservée. (Rien ne se perd, rien ne se gain, tout se transforme)
III. Quelques réactions chimiques :
1. Réaction entre le magnésium et le dioxygène :
a. Expérience
Attention ! Ne pas regarder directement dans la flamme !
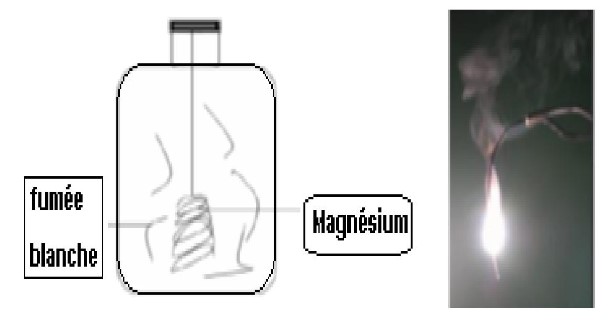
b. Observation
– Le magnésium brûle avec une flamme claire éblouissante.
– A la fin, il reste une poudre blanche appelé oxyde de magnésium de formule $\boldsymbol{M g O}$.
L’apparition d’oxyde de magnésium, et la disparition du magnésium indique une transformation chimique
c. conclusion
– Lors de cette réaction, le magnésium a réagi avec le dioxygène. Le produit formé s’appelle «oxyde de magnésium » de formule $\boldsymbol{M g O}$.
– le bilan de cette réaction :
$\text { Magnésium } + \text { dioxygène } \rightarrow \text { oxyde de magnésium }$
$2 \mathrm{Mg} \quad+\quad \mathbf{O_{2}} \quad \rightarrow \quad 2 \mathrm{MgO}$
2. Réaction entre le fer et le soufre
$\text { Fer } + \text { Soufre } \rightarrow \text { Sulfure de fer }$
$\text { Fe } + \mathrm{S} \rightarrow \text { FeS }$
3. combustion du butane
$ \text { Butane }+ \text { dioxygène } \rightarrow \text { eau }+ \text { Dioxyde de Carbone } $
$ 2 \mathrm{C}_{4} \mathrm{H}_{10}+13 \mathrm{O}_{2}+10 \mathrm{H}_{2} \mathrm{O}+8 \mathrm{CO}_{2}$
4. Combustion du fer:
$\text { Fer } + \text { dioxygène } \rightarrow \text { oxyde de Fer magnétique } $
$\text { 3Fe } + 202 \rightarrow \mathrm{Fe}_{3} \mathrm{O}_{4}$
N.B: $10 \mathrm{H}_{2} \mathrm{O}_{1} $
$10$ coefficients stœchiométriques
$2$ est un indice qui indique le nombre d’atomes d’Hydrogène
$1$ est un indice qui indique le nombre d’atomes d’oxygène ( 1 n’est pas nécessaire)
En fin j’ai $10 \times 2=20$ atomes d’Hydrogène et $10 \times 1=10$ atomes d’oxygène
Exercice 1:
Placer les mots suivants dans la bonne place : chimique, réactifs, conservation de la masse, physique, produits, réarrangent, réactifs, conservation des atomes, identiques, réactifs.
• Au cours d’une transformation $………………..$ la masse des réactifs est égale à la masse des $………………..$ c’est la loi de la $………………..$
• Au cours d’une transformation chimique, les atomes des $………………..$ se $………………..$ pour former les molécules des $………………..$
• Les atomes présents dans les produits sont $………………..$ en type et en nombre aux atomes présents dans les $………………..$ c’est la loi de la $………………..$
• Au cours d’une transformation chimique, la masse des réactifs est égale à la masse des produits, c’est la loi de la conservation de la masse.
• Au cours d’une transformation chimique, les atomes des réactifs se réarrangent pour former les molécules des produits.
• Les atomes présents dans les produits sont identiques en type et en nombre aux atomes présents dans les réactifs, c’est la loi de la conservation des atomes.
Exercice 2:
Répondre par Vrai ou Faux
• Les produits disparaissent pendant la réaction chimique $………….$
• La réaction du soufre et du fer est une réaction de combustion $………….$
• Toutes les combustions sont des réactions chimique $………….$
• Lors d’une réaction chimique la masse diminue $………….$
• Lors d’une réaction chimique les réactifs disparaissent $………….$
• Au cours d’une réaction chimique les molécules se conservent $………….$
• Les produits disparaissent pendant la réaction chimique Faux
• La réaction du soufre et du fer est une réaction de combustion Faux
• Toutes les combustions sont des réactions chimique Vrai
• Lors d’une réaction chimique la masse diminue Faux
• Lors d’une réaction chimique les réactifs disparaissent Vrai
• Au cours d’une réaction chimique les molécules se conservent Faux
Exercice 3:
La molécule du dioxyde de carbone a pour formule chimique : $\mathrm{CO}_{2}$ complète le tableau :
$\begin{array} {|r|r|}\hline Nombre \quad de \quad molécules \quad de \quad \mathrm{CO}_{2} & Nombre \quad d’atomes \quad de \quad carbone & Nombre \quad d’atome \quad d’oxygène \\ \hline 1 \quad \quad \quad & 1 \quad \quad \quad & 2 \quad \quad \quad \\ \hline 3 \quad \quad \quad & 3 \quad \quad \quad & ……………………………… \\ \hline 5 \quad \quad \quad & ……………………………… & ………………………………. \\ \hline ……………………………… & ………………………………. & 4\quad \quad \quad \\ \hline ………………………………. & 4 \quad \quad \quad & ………………………………. \\ \hline \end{array}$
$\begin{array} {|r|r|}\hline Nombre \quad de \quad molécules \quad de \quad \mathrm{CO}_{2} & Nombre \quad d’atomes \quad de \quad carbone & Nombre \quad d’atome \quad d’oxygène \\ \hline 1 \quad \quad \quad & 1 \quad \quad \quad & 2 \quad \quad \quad \\ \hline 3 \quad \quad \quad & 3 \quad \quad \quad & 6 \quad \quad \quad \\ \hline 5 \quad \quad \quad & 5 \quad \quad \quad & 10 \quad \quad \quad \\ \hline 2 \quad \quad \quad & 2 \quad \quad \quad & 4\quad \quad \quad \\ \hline 4 \quad \quad \quad & 4 \quad \quad \quad & 8 \quad \quad \quad \\ \hline \end{array}$
Exercice 4:
L’équation de la réaction chimique de la combustion du méthane s’écrit : $ \text { Méthane }+ \text { dioxygène } \rightarrow \text { eau }+ \text { Dioxyde de Carbone }$
Lors de cette transformation, les masses des réactifs et des produits sont mesurées mais certaines ont été perdues.
$1)$ Complète le tableau suivant :
$\begin{array} {|r|r|}\hline & Masse \quad de \quad méthane & Masse \quad de \quad dioxygène & Masse \quad de \quad dioxyde \quad de \quad carbone & Masse \quad d’eau \\ \hline 1^{\text {ère }} \quad transformation & 44 g \quad \quad & 160 g \quad \quad & \ldots \ldots \ldots \ldots \ldots \ldots \ldots \ldots \ldots & 72 g \quad \quad \\ \hline 2^{\text {ème }} \quad transformation & \ldots \ldots \ldots \ldots & 80 g \quad \quad & 66 g \quad \quad & 38 g \\ \hline \end{array}$
$2)$ écrire l’équation de la réaction chimique de la combustion du méthane en utilisant les symboles.
$1)$ Complète le tableau suivant :
$\begin{array} {|r|r|}\hline & Masse \quad de \quad méthane & Masse \quad de \quad dioxygène & Masse \quad de \quad dioxyde \quad de \quad carbone & Masse \quad d’eau \\ \hline 1^{\text {ère }} \quad transformation & 44 g \quad \quad & 160 g \quad \quad & 132 g & 72 g \quad \quad \\ \hline 2^{\text {ème }} \quad transformation & 24 & 80 g \quad \quad & 66 g \quad \quad & 38 g \\ \hline \end{array}$
$2)$ $ 2 \mathrm{C} \mathrm{H}_{4}+4 \mathrm{O}_{2} \rightarrow 4 \mathrm{H}_{2} \mathrm{O}+2 \mathrm{CO}_{2}$
Exercice 5:
Choisir la bonne réponse
Avec $22$ atomes de carbone et $40$ atomes d’oxygène, on peut fabriquer :
$1)$ $20$ molécules de dioxyde de carbone
$2)$ $22$ molécules de dioxyde de carbone
$3)$ $24$ molécules de dioxyde de carbone
$4)$ $40$ molécules de dioxyde de carbone
$1)$ $20$ molécules de dioxyde de carbone
Exercice 6:
En appliquant les lois de la réaction chimique, équilibrés les équations suivantes:
$\mathrm{Fe}+\ldots \longrightarrow \mathrm{FeS}$
$2 \mathrm{C}_{4}\mathrm{H}_{10}+\ldots \mathrm{O}_{2} \longrightarrow 8 \mathrm{CO}_{2} + 10 \mathrm{H}_{2}\mathrm{O}$
$ \ldots .+\mathrm{Cl}_{2} \longrightarrow \mathrm{CH}_{3} \mathrm{Cl}+\mathrm{HCl}$
$2 \mathrm{Al}+3 \ldots . \longrightarrow \mathrm{Al}_{2}\mathrm{O}_{3}+ 3\mathrm{H}_{2} $
$ \mathrm{Fe}+ S \longrightarrow \mathrm{FeS}$
$2 \mathrm{C}_{4}\mathrm{H}_{10}+ 13 \mathrm{O}_{2} \longrightarrow 8 \mathrm{CO}_{2} + 10 \mathrm{H}_{2}\mathrm{O}$
$ \mathrm{CH}_{4} +\mathrm{Cl}_{2} \longrightarrow \mathrm{CH}_{3} \mathrm{Cl}+\mathrm{HCl}$
$2 \mathrm{Al}+3 \mathrm{H}_{2}\mathrm{O} \longrightarrow \mathrm{Al}_{2}\mathrm{O}_{3}+ 3\mathrm{H}_{2} $
Exercice 7:
Equilibrer les équations chimiques de combustion suivantes en utilisant la loi de conservation des atomes:
$ \mathrm{CH}_{4}+\mathrm{O}_{2} \longrightarrow \mathrm{CO}_{2}+\mathrm{H}_{2} \mathrm{O} $
$ \mathrm{C}_{3} \mathrm{H}_{8}+\mathrm{O}_{2} \longrightarrow \mathrm{CO}_{2}+\mathrm{H}_{2} \mathrm{O} $
$ \mathrm{C}_{5} \mathrm{H}_{12}+\mathrm{O}_{2} \longrightarrow \mathrm{CO}_{2}+\mathrm{H}_{2} \mathrm{O} $
$ \mathrm{Al}+\mathrm{O}_{2} \longrightarrow \mathrm{Al}_{2} \mathrm{O}_{3} $
$ \mathrm{C}+\mathrm{CuO} \longrightarrow \mathrm{Cu}+\mathrm{CO}_{2} $
$ \mathrm{CO}_{2}+\mathrm{H}_{2} \mathrm{O} \longrightarrow \mathrm{C}_{6} \mathrm{H}_{12} \mathrm{O}_{6}+\mathrm{O}_{2} $
$ \mathrm{H}_{2}+\mathrm{Fe}_{3} \mathrm{O}_{4} \longrightarrow \mathrm{Fe}+\mathrm{H}_{2} \mathrm{O} $
$ \mathrm{H}_{2} \mathrm{O}+\mathrm{CH}_{4} \longrightarrow \mathrm{CO}+\mathrm{H}_{2} $
$ \mathrm{Na}_{2} \mathrm{O}_{2}+\mathrm{H}_{2} \mathrm{O} \longrightarrow \quad \mathrm{NaOH}+\mathrm{O}_{2} $
$ \mathrm{H}_{2} \mathrm{O}+\mathrm{Al} \longrightarrow \mathrm{Al}_{2} \mathrm{O}_{3}+\mathrm{H}_{2}$
$ \mathrm{CH}_{4} + 2\mathrm{O}_{2} \longrightarrow \mathrm{CO}_{2}+ 2\mathrm{H}_{2} \mathrm{O} $
$ \mathrm{C}_{3} \mathrm{H}_{8} + 5\mathrm{O}_{2} \longrightarrow 3\mathrm{CO}_{2} + 4\mathrm{H}_{2} \mathrm{O} $
$ \mathrm{C}_{5} \mathrm{H}_{12} + 8\mathrm{O}_{2} \longrightarrow 5\mathrm{CO}_{2} + 6\mathrm{H}_{2} \mathrm{O} $
$ 4\mathrm{Al} + 3\mathrm{O}_{2} \longrightarrow 2\mathrm{Al}_{2} \mathrm{O}_{3} $
$ \mathrm{C} + 2\mathrm{CuO} \longrightarrow 2\mathrm{Cu}+\mathrm{CO}_{2} $
$ 6\mathrm{CO}_{2} + 6\mathrm{H}_{2} \mathrm{O} \longrightarrow \mathrm{C}_{6} \mathrm{H}_{12} \mathrm{O}_{6}+ 6\mathrm{O}_{2} $
$ 4\mathrm{H}_{2} + \mathrm{Fe}_{3} \mathrm{O}_{4} \longrightarrow 3\mathrm{Fe} + 4\mathrm{H}_{2} \mathrm{O} $
$ \mathrm{H}_{2} \mathrm{O} + \mathrm{CH}_{4} \longrightarrow \mathrm{CO} + 2\mathrm{H}_{2} $
$ 2\mathrm{Na}_{2} \mathrm{O}_{2} + 2\mathrm{H}_{2} \mathrm{O} \longrightarrow \quad 4\mathrm{NaOH}+\mathrm{O}_{2} $
$ 6\mathrm{H}_{2} \mathrm{O} + 4\mathrm{Al} \longrightarrow 2\mathrm{Al}_{2} \mathrm{O}_{3} + 6\mathrm{H}_{2}$
Exercice 8:
La combustion de $m_{1}=12 \mathrm{~g}$ de carbone nécessite une masse $m_{2}=32 \mathrm{~g}$ du dioxygène, cette réaction produit le dioxyde de carbone.
$1)$ Donner le bilan littéral de cette réaction chimique ?
$2)$ Rappeler la loi de conservation de la masse au cours d’une réaction chimique ?
$3)$ Calculer la masse $m$ du dioxyde de carbone produite ?
$1)$ $\text { Carbone } +\text { Dioxygène } + \rightarrow \text { Dioxyde de Carbone }$
$2)$ Au cours d’une réaction chimique, la masse se conserve.
$3)$ D’après la loi de la conservation de la masse :
On a : $\quad m_{1}+m_{2}=m$
Alors : $\quad m=12 g+32 g$
Donc: $m=448$
Exercice 9:
La combustion du soufre dans le dioxygène produit un gaz toxique appelé le dioxyde de soufre.
$1)$ Écrire le bilan littéral de cette réaction chimique.
$2)$ Pour obtenir une quantité du dioxyde de soufre de masse $m=6 g$ nous brulons une masse $m_{1}=5 g$ de soufre dans une masse $\mathbf{m}_{\mathbf{2}}=3 \mathrm{~g}$ du dioxygène.
$\rightarrow$ Calculer la masse $m^{\prime}$ de soufre restée à la fin de la réaction.
$1)$ $\text { Soufre + dioxygène } \rightarrow \text { Dioxyde de soufre }$
$2)$ La masse $\mathbf{m}$ de soufre restée à la fin de la réaction.
On a : $m_{1}+m_{2}=5 g+3 g$
Alors : $m_{1}+m_{2}=8 g$
Et on a : $\mathrm{m}=6 \mathrm{~g}$
Alors : $m^{\prime}=8 g-6 g$
Donc : $m^{\prime}=2 g$
Exercice 10:
La combustion de $m_{1}=64.85 \mathrm{~g}$ d’éthane dans une masse $m_{2}$ du dioxygène conduit à la formation de $m_{3}=$ 76.85 g du dioxyde de carbone et $\mathrm{m}_{4}=3 \mathrm{~g}$ de l’eau.
$1)$ Donner les corps:
$a)$ Réactifs
$b)$ Les produits
$2)$ Écrire le bilan littéral de cette transformation chimique.
$3)$ Rappeler la loi de la conservation de la masse au cours d’une réaction chimique.
$4)$ Calculer la masse $m_{2}$ du dioxygène.
$5)$ Sachant que la combustion de $9.6 \mathrm{~g}$ d’éthane nécessite $19.2 \mathrm{~g}$ , calculer la masse d’éthane qui brûle $7.2 \mathrm{~L}$ du dioxygène.
$1)$ Donner les:
$a)$ Réactifs : éthane et dioxygène.
$b)$ Les produits : dioxyde de carbone et l’eau.
$2)$ $\text { Ethane + dioxygène } \rightarrow \text { Dioxyde de carbone + eau }$
$3)$ Au cours d’une réaction chimique, la masse se conserve.
$4)$ D’après la loi de la conservation de la masse :
On a : $m_{1}+m_{2}=m_{3}+m_{4}$
Alors : $m_{2}=m_{3}+m_{4}-m_{1}$
A.N : $m_{2}=76.85+3-64.85$
Donc : $m_{2}=15 g$
$5)$ On a : $\quad 9.6 \mathrm{~g}$ (éthane) $\rightarrow 19.2 \mathrm{~L}$ (dioxygène)
$\text { m (éthane) } \rightarrow 7.2 \mathrm{~L} \text { (dioxygène) }$
Alors : $\mathrm{m} \text { (éthane) }=\frac{7.2 \times 9.6}{19.2}$
Donc : $\mathrm{m}=3.6 \mathrm{~g}$
Exercice 11:
L’équation bilan de la combustion complète de l’éthane s’écrit :
$ 2\mathrm{C}_{2} \mathrm{H}_{x} + y\mathrm{O}_{2} \longrightarrow 4\mathrm{CO}_{2} + 6\mathrm{H}_{2} \mathrm{O} $
On réalise la combustion de $6 \mathrm{~g}$ d’éthane en présence de dioxygène. On recueille les produits puis on les pèse. On
trouve $17,6 \mathrm{~g}$ de dioxyde de carbone et $10,8 \mathrm{~g}$ d’eau.
$1)$ Déterminer les valeurs de $ x$ et $ y$ .
$2)$ Calculer la masse de dioxygène ?
$1)$ $ 2\mathrm{C}_{2} \mathrm{H}_{6} + 4\mathrm{O}_{2} \longrightarrow 4\mathrm{CO}_{2} + 6\mathrm{H}_{2} \mathrm{O} $
$2)$ Calculer la masse de dioxygène ?
$m(\mathrm{C}_{2} \mathrm{H}_{6}) + m(\mathrm{O}_{2}) = m(\mathrm{CO}_{2}) + m(\mathrm{H}_{2} \mathrm{O} )$
$ m(\mathrm{O}_{2}) = m(\mathrm{CO}_{2}) + m(\mathrm{H}_{2} \mathrm{O} )-m(\mathrm{C}_{2} \mathrm{H}_{6}) $
$ m(\mathrm{O}_{2}) = 17,6 g + 10,8 g-6 g $
$ m(\mathrm{O}_{2}) = 22,4 g$
Les lois de la réaction chimique exercices corrigés
