Les solutions acides et basiques exercices corrigés
Les solutions acides et basiques
I-Solution aqueuse :
Une solution aqueuse est un mélange d’un ou plusieurs solutés dissous dans de le solvant qui est l’eau.
Exemples:
Solution de chlorure de sodium ( $\mathrm{Na}^{+}, \mathrm{Cl}^{-}$).
(‘acide chlorhydrique ou solution de chlorure d’hydrogène ( $\mathrm{H}^{+}, \mathrm{Cl}^{-}$).
(a soude ou solution d’hydroxyde de sodium ( $\mathrm{Na}^{+}, \mathrm{OH}^{-}$).
II-pH d’une solution aqueuse :
1)-Notion du pH :
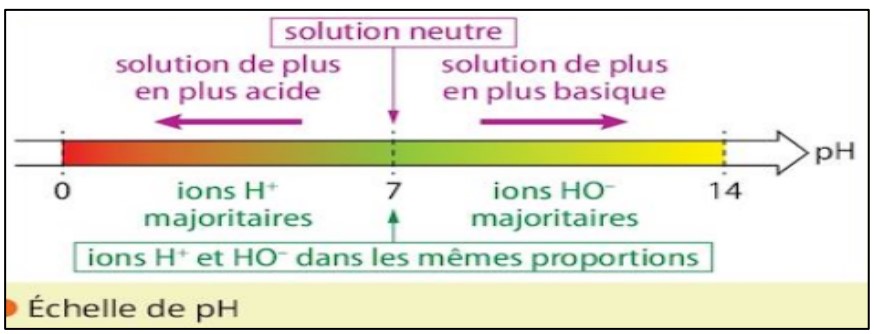
Le $\mathbf{p H}$ est un nombre sans unité, compris entre $0$ et $14$ qui permet de déterminer le degré d’acidité d’une solution aqueuse.
2)-Mesure de pH des solutions :
On mesure le pH d’une solution aqueuse avec : le $\mathbf{p H}$ -mètre ou le papier $\mathbf{p H}$

Le papier $\mathbf{p H}$ est un papier qui prend des couleurs selon la nature de la solution ou il se trouve.
A chaque couleur correspond un nombre sur la boite qui est la valeur du $\mathbf{p H}$ de cette solution.
Le $\mathbf{p H}$ -mètre est un appareil de mesure qui permet de déterminer avec précision le pH d’une solution .
Le papier $\mathbf{p H}$ donne une valeur approché du $\mathbf{p H}$ mais le $\mathbf{p H}$-mètre donne une valeur plus précise.
3)- classification des solutions aqueuses :
Activité :
On mesure le $\mathbf{p H}$ de différentes solutions aqueuses avec le $\mathbf{p H}$ -mètre :
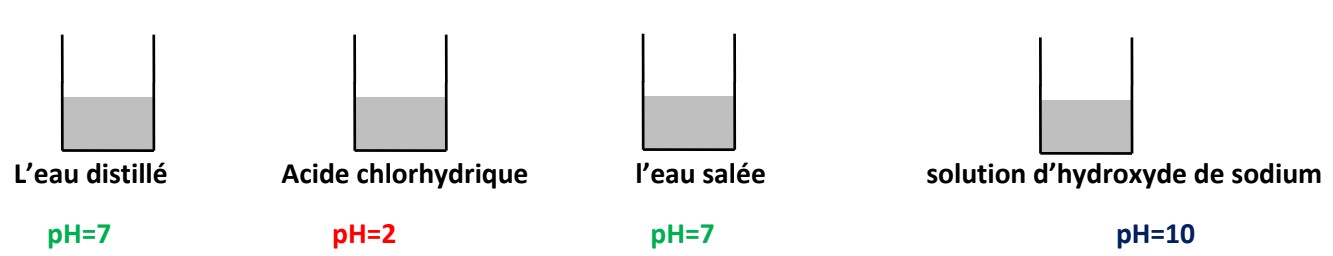
Conclusion :
On classe les solutions en trois types selon le $\mathbf{p H}$ :
$\checkmark$ Si le $\mathbf{p H}$ est inférieur à $7(0<\mathbf{p H}<7)$ la solution est acide
$\checkmark$ Si le $\mathbf{p H}$ est supérieur à $7(14>\mathrm{pH}>7)$ la solution est basique.
$\checkmark$ Si le $\mathbf{p H}$ est égal à $7 \quad(\mathrm{pH}=7)$ la solution est neutre.
III-pH d’une solution et les ions hydrogène $\mathbf{H}^{+}$et les ions Hydroxyde $\mathbf{H O}^{-}$:
L’eau et toutes les solutions aqueuses contiennent des ions hydrogène $\mathrm{H}^{+}$et de l’hydroxyde $\mathrm{HO}^{-}$
• Les solutions neutres : contiennent le même nombre d’ions $\mathrm{H}^{+}$et $\mathrm{HO}^{-}$
• Les solutions acides : Le nombre d’ions $\mathrm{H}^{+}$est supérieur au nombre d’ions $\mathrm{HO}^{-}$
• Les solutions basiques : le nombre d’ions $\mathrm{HO}^{-}$est supérieur au nombre d’ions $\mathrm{H}^{+}$
IV-Dilution d’une solution aqueuse :
Activité:
On mesure le $\mathbf{p H}$ d’une solution aqueuse acide et on ajoute l’eau de la solution.
Puis on mesure le $\mathbf{p H}$de la solution obtnue.
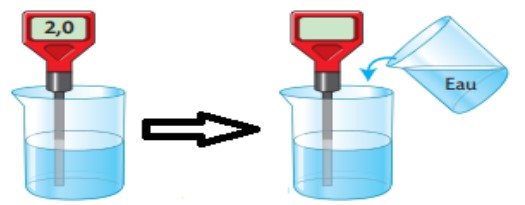
Observations:
$\checkmark$ Lorsque on ajoute l’eau a une solution aqueuse acide la valeur de $\mathbf{p H}$ augmente.
$\checkmark$ Lorsque on ajoute l’eau a une solution aqueuse basique la valeur de $\mathbf{p H}$ diminue.
Conclusion :
– Les solutions acides ou basiques présentent des dangers pour la santé et l’environnement,il faut les diluer avant de les utiliser.
-La dilution d’une solution aqueuse consiste à ajouter de l’eau à cette solution et il ne faut jamais ajouter de l’eau à un acide concentré.
• Lorsqu’ on dilue une solution acide, l’acidité diminue et la valeur du $\mathbf{p H}$ augmente et se rapproche de $7$ .
• Lorsqu’on dilue une solution basique, la basicité diminue et la valeur du pH diminue et se rapproche de $7$ .
V-Précautions préventives lors de l’utilisation des solutions acides et basiques :
• Lors de la manipulation des produits acides et basiques, il est nécessaire de :
$\checkmark$ Respecter les règles de sécurité.
$\checkmark$ Porter un vêtement de protection, des gants, un équipement de protection des yeux et du visage.
$\checkmark$ Suivre les consignes en cas d’accident.
Exercice 1:
Complétez les phrases suivantes :
• Une solution acide a un $\mathbf{p H}$ $………$ à $7$
• Une solution basique a un $\mathbf{p H}$ $………$ à $7 $
• pH d’une solution neutre $………$ à $7$
• Lorsqu’on dilue une solution acide le $\mathbf{p H}$ $………$ mais reste $………$ à $7$
• Lorsqu’on dilue une solution basique le $\mathbf{p H}$ $………$.et la basicité $………$ également.
• Une solution acide a un $\mathbf{p H}$ inférieur à $7$
• Une solution basique a un $\mathbf{p H}$ supérieur à $7 $
• $\mathbf{p H}$ d’une solution neutre égal à $7$
• Lorsqu’on dilue une solution acide le $\mathbf{p H}$ augmente mais reste inférieur à $7$
• Lorsqu’on dilue une solution basique le $\mathbf{p H}$ diminue et la basicité diminue également.
Exercice 2:
Placer les mots suivants dans la bonne place : Papier $\mathbf{p H}$ –nombre – dangereuses – $\mathbf{p H}$ mètre
• Le $\mathbf{p H}$ est un $…………$ sans unité compris entre $0$ et $14$ permettent de connaître le caractère plus ou moins acide d’une solution.
• Il existe deux méthodes permettant de mesurer le $\mathbf{p H}$ d’une solution : le $…………$ et le $…………$
• Les solutions acides ou basiques, surtout de forte concentration, sont $…………$
• Le $\mathbf{p H}$ est un nombre sans unité compris entre $0$ et $14$ permettent de connaître le caractère plus ou moins acide d’une solution.
• Il existe deux méthodes permettant de mesurer le $\mathbf{p H}$ d’une solution : le Papier $\mathbf{p H}$ et le $\mathbf{p H}$ mètre
• Les solutions acides ou basiques, surtout de forte concentration, sont dangereuses
Les solutions acides et basiques exercices corrigés
Exercice 3:
Répondre par Vrai ou par Faux
• Le jus de citron a un $\mathbf{p H}$ de $2$. S’agit-il d’une base
• Lorsqu’on dilue une solution acide, son $\mathbf{p H}$ augmente.
• Lorsqu’on dilue une solution basique, son $\mathbf{p H}$ diminue.
• Plus le $\mathbf{p H}$ d’une solution est faible, plus la solution est acide.
• La dilution d’une solution aqueuse sert à rendre la solution plus concentrée.
• Lorsqu’on dilue une solution acide, son $\mathbf{p H}$ diminue.
• Le jus de citron a un $\mathbf{p H}$ de $2$. S’agit-il d’une base Faux
• Lorsqu’on dilue une solution acide, son $\mathbf{p H}$ augmente. Vrai
• Lorsqu’on dilue une solution basique, son $\mathbf{p H}$ diminue. Vrai
• Plus le $\mathbf{p H}$ d’une solution est faible, plus la solution est acide. Vrai
• La dilution d’une solution aqueuse sert à rendre la solution plus concentrée. Faux
• Lorsqu’on dilue une solution acide, son $\mathbf{p H}$ diminue. Faux
Exercice 4:
Nous mesurons avec un pH-mètre la valeur du pH des solutions suivantes :
Acide nitrique ( $\mathrm{pH}=3$ ) ; eau salée ( $\mathrm{pH}=8.2$ ) ; eau de javel ( $\mathrm{pH}=11.5$ ) ; eau de robinet ( $\mathrm{pH}=7.2$ ) ; acide chlorhydrique ( $\mathrm{pH}=4$ ).
* Identifier:
$1)$ La solution la plus acide est : Acide nitrique ($\mathrm{pH}=3$)
$2)$ La solution la moins acide est : acide chlorhydrique ( $\mathrm{pH}=4$ )
$3)$ La solution neutre est : eau pure ( $\mathrm{pH}=7$ )
$4)$ La solution la plus basique est : eau de javel ( $\mathrm{pH}=8$ )
$5)$ La solution la moins basique : eau de robinet ( $\mathrm{pH}=7.2$ )
Exercice 5:
On considère le tableau suivant :
$\begin{array} {|r|r|}\hline Solution & A & B & C & D & E & F & G & H & K \\ \hline \mathrm{pH} \quad & 8 & 2 & 9 & 7 & 3 & 6 & 10 & 11 & 4 \\ \hline \end{array}$
$1)$ Ces mesures sont-elles effectuées avec le papier $\mathrm{pH}$ ou avec le $\mathrm{pH}$ -mètre ? Justifier votre réponse
$2)$ Classer ces solutions en solutions neutres, basiques et acides. Justifier votre réponse
$3)$ Classer les solutions acides de ce tableau par acidité croissantes.
$1)$ Ces mesures sont effectuées avec le papier $\mathrm{pH}$ car les valeurs du $\mathrm{pH}$ données sont des nombres entiers naturels.
$2)$ On classe ces solutions :
* Solutions acides (car leurs $\mathrm{pH}<7$) : $B ; E ; F ; K$.
* Solutions neutres (car leurs $\mathrm{pH}=7$) : $D$
* Solutions basiques (car leurs $\mathrm{pH}>7$) : $A ; C ; G ; H$.
$3)$ On classe les solutions acides par acidité croissante :
$F(\mathrm{pH}=6)<K(\mathrm{pH}=4)<E(\mathrm{pH}=3)<B(\mathrm{pH}=2)$
Exercice 6:
On considère les solutions suivantes :
$\begin{array} {|r|r|}\hline Solution & A & B & C & D & E & F \\ \hline \mathrm{pH} \quad & 7,0 & 2,1 & 10,5 & 12,3 & 5,25 & 9,7 \\ \hline \end{array}$
$1)$ Avec quel moyen on a mesuré le $\mathrm{pH}$ de ces solutions ? Justifier votre réponse.
$2)$ Classer les solutions dans le tableau en solution acide, basique ou neutre.
$3)$ Quelle est la solution la plus acide et la solution la plus basique.
$4)$ Classer les solutions basiques de plus basique au moins basique.
$1)$ Le $\mathrm{pH}$-mètre , car il permet une mesure rapide et précise du $\mathrm{pH}$ (en général au dixième près).
$2)$
Solution acide : $B ; E$
Solution basique : $C ; D ; F $
Solution neutre : $A$
$3)$ la solution la plus acide : $B$
la solution la plus basique : $D$
$4)$ $D(\mathrm{pH}=12,3)>C(\mathrm{pH}=10,5)>F(\mathrm{pH}=9,7)$
Exercice 7:
$1)$ Quel est l’ion responsable de l’acidité d’une solution aqueuse.
$2)$ Quel est l’ion responsable de la basicité d’une solution aqueuse.
$3)$ Une solution qui contient davantage d’ions hydrogène $\mathrm{H}^{+}$ que d’ions hydroxyde $\mathrm{HO}^{-}$ est ( acide / basique).
$4)$ Une solution qui contient davantage d’ions hydrogène $\mathrm{H}^{+}$ que d’ions hydroxyde $\mathrm{HO}^{-}$ est ( acide / basique).
$1)$ Lion responsable de l’acidité d’une solution aqueuse est : $\mathrm{H}^{+}$
$2)$ L’ion responsable de la basicité d’une solution aqueuse : $\mathrm{HO}^{-}$
$3)$ Une solution qui contient davantage d’ions hydrogène $\mathrm{H}^{+}$ que d’ions hydroxyde $\mathrm{HO}^{-}$ est acide .
$4)$ Une solution qui contient davantage d’ions hydrogène $\mathrm{H}^{+}$ que d’ions hydroxyde $\mathrm{HO}^{-}$ est basique.
Exercice 8:
Un élève a ajouté $\mathbf{8 0 ~ m l}$ d’eau pure à un volume d’un jus de citron de $\mathbf{p H = 3 . 7}$.
$1)$ Quelle est le type de cette solution.
$2)$ Comment on a mesuré le $\mathrm{pH}$ de cette solution ? justifier votre réponse
$3)$ Comment appelons-nous l’opération effectuée par cet élève ?
$4)$ Comment varie la valeur du $\mathrm{pH}$ après l’ajout de $\mathbf{8 0 ~ m l}$ d’eau pure ?
$5)$ La solution contient davantage d’ions hydrogène $\mathrm{H}^{+}$ ou d’ions hydroxyde $\mathrm{HO}^{-}$ .
$1)$ C’est une solution acide car le $\mathrm{pH}<7$.
$2)$ On a mesuré le $\mathrm{pH}$ de cette solution avec le $\mathrm{pH}$ -mètre car la valeur donnée est précise (un nombre décimal).
$3)$ Nous appelons l’opération effectuée par cet élève la dilution.
$4)$ La valeur du $\mathrm{pH}$ après l’ajout de $\mathbf{8 0 ~ m l}$ d’eau pure va augmenter.
$5)$ $\mathrm{H}^{+}$ (solution acide)
Exercice 9:
On considère les solutions suivantes :
$\begin{array} {|r|r|}\hline Solution & A & B & C & D & E & F \\ \hline \mathrm{pH} \quad & 7,00 & 1,1 & 11,5 & 13,3 & 5,02 & 9,06 \\ \hline \end{array}$
$1)$ Quelle est la méthode utilisée pour mesurer le $\mathrm{pH}$ de ces solutions ? Justifier votre réponse.
$2)$ Classer les solutions dans le tableau en solution acide, basique ou neutre.
$3)$ Identifier la solution la plus acide et la solution la plus basique
$4)$ Identifier la solution le moins acide et la solution le moins basique
$5)$ Identifier la solution qui contient plus d’ions de $\mathrm{H}^{+}$ et la solution qui contient plus d’ions $\mathrm{HO}^{-}$
$6)$ On mélange une quantité de la solution $D$ avec de l’eau
$a)$ Nommez cette manipulation ? à quoi il sert ?
$b)$ Est-ce que la valeur du $\mathrm{pH}$ va augmenter ou diminuer ? justifiez
$c)$ Classez les solutions basiques de plus basique au moins basique
$1)$ Avec le $\mathrm{pH}$ -mètre car la valeur donnée est précise (un nombre décimal).
$2)$
acide : $B ; E$
basique : $C ; D ; F$
neutre : $A$
$3)$ La solution la plus acide : $B$
La solution la plus basique : $D$
$4)$ La solution le moins acide : $E$
La solution le moins basique : $F$
$5)$ La solution qui contient plus d’ions de $\mathrm{H}^{+}$ : $B$
La solution qui contient plus d’ions $\mathrm{HO}^{-}$ : $D$
$6)$ On mélange une quantité de la solution $D$ avec de l’eau
$a)$ La dilution , il sert a rendre les solutions acides et basiques moins dangereuses.
$b)$ la valeur du $\mathrm{pH}$ va diminuer
$c)$ $D(\mathrm{pH}=13,3)>C(\mathrm{pH}=11,5)>F(\mathrm{pH}=9,06)$
Exercice 10:
Antoine presse un citron et verse $\mathbf{1 ~ m l}$ de jus dans trois béchers $A,B$ et $C$. Il rajoute 10ml d’eau dans le bécher $B$ et $\mathbf{100 ~ m l}$ dans le bécher $C$.
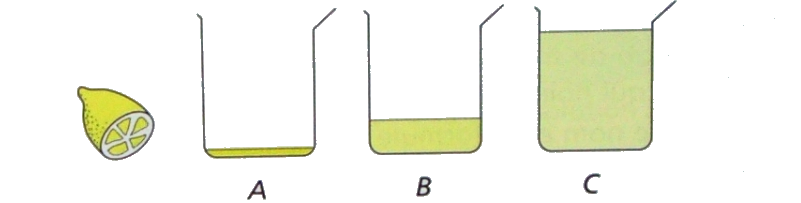
Il agite les solutions et mesure leur $\mathrm{pH}$.
Il trouve les résultats suivant inscrits dans le désordre : $\mathrm{pH}=3,6$ ; $\mathrm{pH}=2,6$ ; $\mathrm{pH}=3,1$.
$1)$ Attribue à chaque bécher $A, B $, et $C$ la valeur du $\mathrm{pH}=3,6$ de la solution en justifiant ta réponse.
$2)$ Le protocole décrit dans cet exercice ne respecte pas une règle de sécurité. Expliquez. Les solutions acides et basiques exercices corrigés
$ 1)$
bécher $A$ : $\mathrm{pH}=2,6$ (le citron sans eau)
bécher $B$ : $\mathrm{pH}=3,1$ (le citron dilue avec $\mathbf{10 ~ m l}$ d’eau)
bécher $C$ : $\mathrm{pH}=3,6$ (le citron dilue avec $\mathbf{100 ~ m l}$ d’eau)
$ 2)$ Pour diluer un acide , on verse lentement en l’acide sur l’eau et non le contraire .
Exercice 11:
On mesure le $\mathrm{pH}$ d’une solution avant et après dilution.
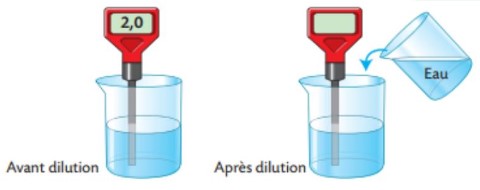
$1)$ Avant la dilution, la solution est-elle acide, basique ou neutre? Justifie.
$2)$ Rappelle la formule des ions hydrogène et des ions hydroxyde.
$3)$ Quels sont les ions majoritaires dans la solution avant dilution?
$4)$ Voici $3$ valeurs de $\mathrm{pH}$: $1,5 ; 2,5; 8,5$.
Parmi ces valeurs, quelle est celle que l’on peut mesurer après dilution de la solution? Justifie.
$1)$ La solution a un $\mathrm{pH}$ inférieur à $7$, elle est donc acide.
$2)$ L’ ion hydrogène a pour formule $\mathrm{H}^{+}$.
L ‘ion hydroxyde a pour formule $\mathrm{HO}^{-}$.
$3)$ Une solution acide contient plus d’ions hydrogène $\mathrm{H}^{+}$ que d’ions hydroxyde $\mathrm{HO}^{-}$.
$4)$ Le $\mathrm{pH}$ d’une solution acide que l’on dilue augmente, mais reste inférieur à $7$: c’est donc la valeur $2,5$ qui est la bonne.
Exercice 12:
Une solution dont le $\mathrm{pH}=12$ contient $\mathrm{6×10}^{11}$ ions $\mathrm{H}^{+}$ par litre.
Sachant que la valeur du $\mathrm{pH}$ diminue d’une unité quand le nombre d’ion $\mathrm{H}^{+}$ est multiplié par $10$
$1)$ Trouver la valeur du $\mathrm{pH}$ d’une solution contenant $\mathrm{6×10}^{16}$ ions $\mathrm{H}^{+}$ par litre.
$2)$ Trouver la valeur du $\mathrm{pH}$ d’une solution contenant $\mathrm{6×10}^{21}$ ions $\mathrm{H}^{+}$ par litre.
$3)$ Quelle sera le nombre d’ion $\mathrm{HO}^{-}$ dans un litre de solution de $\mathrm{pH}=7$
$1)$ Compare les deux quantités :
$\frac{6 \times 10^{16}}{6 \times 10^{11}}=10^{5}$
Donc, on a multiplié le nombre d’ions $H^{+}$par $100000=10^{5}$
$\Rightarrow$ Le pH diminue de 5 unités.
Donc : $\mathrm{pH}=12-5=7$
$2)$ $\frac{6 \times 10^{21}}{6 \times 10^{11}}=10^{10}$
$\Rightarrow$ Le pH diminue de $10$ unités.
Donc: $\mathrm{pH}=12-10=2$
$3)$ Dans l’eau pure, à $\mathrm{pH}=7$, la solution est neutre.
Donc : $\text { Nombre d’ions } \mathrm{H}^{+}=\text {Nombre d’ions }\mathrm{HO}^{-}$
On a vu à la question $1$ que $\mathrm{pH}=7$ correspond à $6 \times 10^{16}$ ions $\mathrm{H}^{+}$par litre.
Donc : $\text { Nombre d’ions } \mathrm{HO}^{-}=6 \times 10^{16}$
Les solutions acides et basiques exercices corrigés
