L’étude de l’oxydation des métaux dans l’air en classe de 3ème est cruciale pour plusieurs raisons. Tout d’abord, elle permet aux élèves de comprendre un phénomène chimique communément observé dans la vie quotidienne.
En comprenant pourquoi les métaux, tels que le fer, rouillent au contact de l’oxygène de l’air, les élèves développent une compréhension plus profonde de la réactivité chimique.
Oxydation des métaux dans l’air – exercices corrigés : Cliquez ici
Oxydation de quelques métaux dans l’air
I- Introduction
L’air contient principalement du dioxygène, (environ 20 % en volume) et du diazote ( environ 80 % en volume).
On distingue deux sortes d’air :
– L’air sec : la proportion de l’eau est très faible
– l’air humide : très riche en vapeur d’eau
II- Oxydation du fer dans l’air humide :
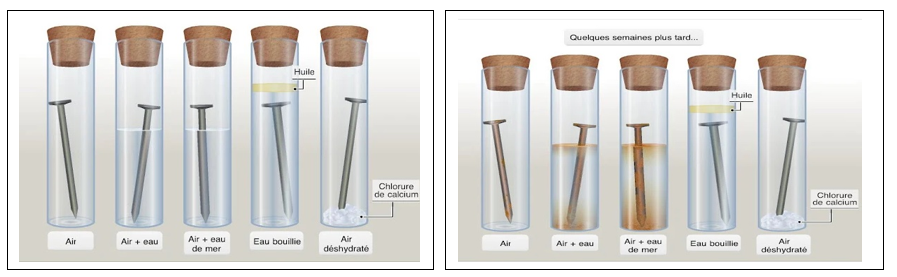
Que se passe-t-il si on laisse une lame en fer exposé dans l’air humide?
Lorsqu’ on laisse une lame en fer dans la nature elle va rouiller doucement, jusqu’à disparaître totalement.
Qu’est ce qui est responsable du phénomène observé ?
Expérience n°1 :
Expérience n°2 :
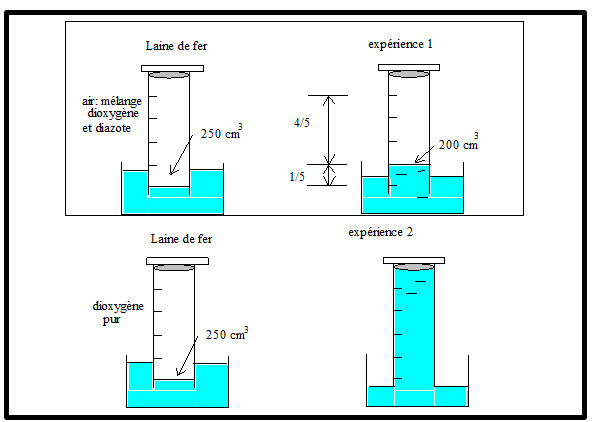
Conclusion :
- Le fer réagit avec le dioxygène en présence d’eau (air humide) pour former de la rouille.
- La rouille est une substance de couleur rougeâtre, elle contient essentiellement d’oxyde de fer III (oxyde ferrique) de formule chimique Fe2O3.
- La formation de la rouille est due à une réaction chimique entre le fer et le dioxygène en présence de l’eau. cette réaction chimique est appelée oxydation de fer car l’oxygène est l’un des réactifs
- Réaction chimique entre le fer et le dioxygène est lente sa vitesse augmente en présence de l’eau salée.
- • Le bilan écriture de la réaction :
Fer + Dioxygène → Oxyde de fer III
• L’équation chimique
4 Fe + 3 O2 → 2 Fe2O3
Remarque :
La rouille est une couche poreuse cette dernière laisse passer l’eau et l’air qui peuvent continuer à réagir avec le fer en profondeur jusqu’à la disparition totale du fer. Ce phénomène est appelé la corrosion..
Pour protéger le fer contre la rouille on peut le recouvrir d’une couche imperméable non poreuse comme :
– la peinture
– le vernis
– l’huile ou graisse
– couche mince d’un métal (zinc – nickel – chrome…)
III- Oxydation d’aluminium dans l’air humide
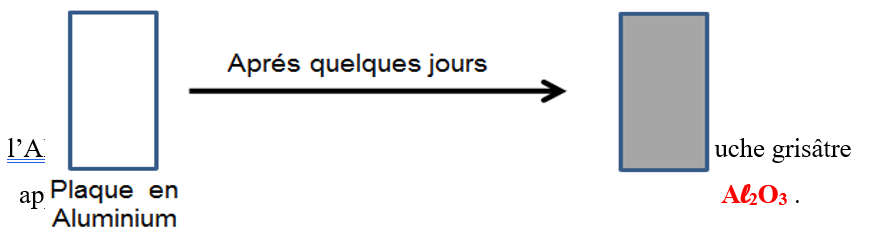
L’action du dioxygène sur l’Aluminium est une réaction chimique lente appelée oxydation d’aluminium.
• Le bilan écriture de la réaction :
Aluminium + Dioxygène → Oxyde d’alumine
• L’équation de la réaction:
4 Al + 3 O2 → 2 Al2O3
Remarque :
L’Alumine est une couche étanche (non poreuse -imperméable à l’air) elle protège le métal d’aluminium contre la corrosion.
IV – Oxydation des métaux
L’oxydation d’un métal est une réaction chimique qui se fait entre un métal et le dioxygène et se produit l’oxyde du métal selon le bilan suivant :
Métal + dioxygène → oxyde du métal
Voir aussi
