Oxydation des métaux dans l’air exercices corrigés
Oxydation des métaux dans l’air
I. L’oxydation de fer dans l’air humide
1. Expérience
– On utilise quatre tubes à essai
– Quatre clous en fer
– Laisser les quatre tubes pendant quelques jours
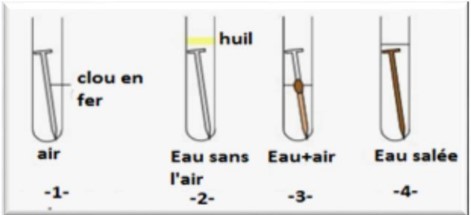
2. Observation :
Au bout de quelques jours :
– Il y a formation de rouille dans les tubes 3 et 4 (eau+air et eau salée)
– La quantité de rouille est plus importante dans le tube 4 que dans le tube 1 .
– Il n’y a pas de rouille dans les deux tubes 1 et 2
3. Interprétation :
– La formation de rouille n’est possible que si le fer est en contact avec de l’air et de l’eau ou plus simplement avec de l’air humide.
– Les facteurs accélérant la formation de la rouille : le chlorure de sodium (sel) est accéléré la formation de la rouille
– Le fer rouille dans l’air humide
4. conclusion
– La rouille est constituée essentiellement d’oxyde ferrique de formule III $\mathrm{Fe}_{2} \mathrm{O}_{3}$ (oxyde de fer III)
Sa formation se fait selon une réaction lente appelée : oxydation
– La formation de la rouille nécessite la présence de fer de dioxygène et de l’eau (air humide)
– L’équation de la réaction s’écrit :
fer + Dioxygène $\quad \rightarrow \quad$ Oxyde ferrique III
– L’équation-bilan s’écrit :
$4$ $Fe \quad $+ $ \quad 3 \mathrm{O}_{2}$ $\quad \rightarrow \quad$ $\mathrm{Fe}_{2} \mathrm{O}_{3}$
5. Protection de fer contre la corrosion :
– La rouille est poreuse .donc la réaction peut se propager en profondeur jusqu’à la disparition complète de fer .ce phénomène est appelé corrosion de fer
– Pour protéger le fer contre la rouille on peut le recouvrir d’une couche de matériau imperméable à l’air, tel que :
la peinture ou le revêtement d’une fine croûte mince de certains métaux n’affectant pas l’air, comme le zinc ou l’aluminium.
– De zinc (galvanisation).
– De matières plastiques, grillage.
– Ou faire un alliage avec du nickel et du chrome (acier inoxydable (inox))
II. oxydation d’aluminium :
1. Expérience :

2. Observation et interprétation :
– L’aluminium s’est recouvert d’une fine couche blanche (gris) d’oxyde d’aluminium appelé alumine de formule $\mathrm{Al}_{2} \mathrm{O}_{3}$. Mais contrairement au fer, la corrosion ne progresse pas en profondeur pour détruire le métal : cet oxyde protège le métal
– L’alumine est une couche qui n’est pas poreuse (impreméable à l’eau et l’air) pérmet de protèger l’aluminium
3. Conclusion
– L’aluminium réagit aves le dioxygéne de l’air en produisant l’oxyde d’aluminium ou l’alumine $\mathrm{Al}_{2} \mathrm{O}_{3}$
– L’équation de la réaction s’écrit :
Aluminium + Dioxygène $\quad \rightarrow \quad$ Oxyde d’aluminium
– L’équation-bilan s’écrit
$4 \mathrm{Al} \quad+\quad 3 \mathrm{O}_{2} \quad \rightarrow \quad \mathrm{Al}_{2} \mathrm{O}_{3}$
Exercice 1:
Compléter les phrases suivantes:
• Le fer s’oxyde lentement à l’air $…………………$ pour donner de la $…………………$ qui est un oxyde de $…………………$ .Cette transformation chimique nécessite le fer, le dioxygène et de l’ $…………………$
• La $…………………$ du fer contre la corrosion se fait en utilisant la $…………………$ ou le $…………………$
• L’alumine est une couche qui n’est pas $…………………$ mais étanche à l’air. Elle empêche l’air d’être au contact de l’$…………………$et le protège contre la$…………………$ .L’aluminium ne peut donc pas s’$…………………$ en profondeur.
• Le fer s’oxyde lentement à l’air sec pour donner de la rouille qui est un oxyde de Fer . Cette transformation chimique nécessite le fer, le dioxygène et de l’ eau
• La protection du fer contre la corrosion se fait en utilisant la peinture ou le vernis
• L’alumine est une couche qui n’est pas poreuse mais étanche à l’air. Elle empêche l’air d’être au contact de l’aluminium et le protège contre la corrosion .L’aluminium ne peut donc pas s’oxyde en profondeur.
Exercice 2:
Répondre par vrai ou faux:
• Le fer rouille plus rapidement dans l’eau de mer que dans l’eau de rivière. $…………………$
• L’alumine est le produit d’oxydation du fer dans le dioxygène. Elle protège le métal. $…………………$
• L’eau est nécessaire pour former la rouille $…………………$
• La formation de la rouille se fait en présence de l’air sec. $…………………$
• L’aluminium s’oxyde jusqu’à sa destruction dans l’air humide. $…………………$
• L’acier est un alliage qui résiste à la corrosion. $…………………$
• Le fer rouille plus rapidement dans l’eau de mer que dans l’eau de rivière. vrai
• L’alumine est le produit d’oxydation du fer dans le dioxygène. Elle protège le métal. faux
• L’eau est nécessaire pour former la rouille vrai
• La formation de la rouille se fait en présence de l’air sec. faux
• L’aluminium s’oxyde jusqu’à sa destruction dans l’air humide. faux
• L’acier est un alliage qui résiste à la corrosion. vrai
Exercice 3:
Cocher la case qui convient pour déterminer les propriétés de la rouille et de l’alumine:
$\begin{array} {|r|r|}\hline & \begin{array} LLa formule \\ chimique \\ \mathrm{Al}_{2} \mathrm{O}_{3} \end{array} & \begin{array} LLa formule \\ chimique \\ \mathrm{Fe}_{2} \mathrm{O}_{3} \end{array} & \begin{array} FFormation \\ d’une \quad couche \\ poreuse \end{array} & \begin{array} FFormation \\ d’une \quad couche \\ imperméable \end{array} & \begin{array} PProvoque \\ la \quad corrosion \\ du \quad métal \end{array} & \begin{array} PProtège \\ le \quad métal \\ de \quad la \quad corrosion \end{array} \\ \hline La rouille & & & & \\ \hline L’alumine & & & & & & \\ \hline \end{array}$
$\begin{array} {|r|r|}\hline & \begin{array} LLa formule \\ chimique \\ \mathrm{Al}_{2} \mathrm{O}_{3} \end{array} & \begin{array} LLa formule \\ chimique \\ \mathrm{Fe}_{2} \mathrm{O}_{3} \end{array} & \begin{array} FFormation \\ d’une \quad couche \\ poreuse \end{array} & \begin{array} FFormation \\ d’une \quad couche \\ imperméable \end{array} & \begin{array} PProvoque \\ la \quad corrosion \\ du \quad métal \end{array} & \begin{array} PProtège \\ le \quad métal \\ de \quad la \quad corrosion \end{array} \\ \hline La \quad rouille & & × \quad & × \quad & & × \quad & \\ \hline L’alumine & × \quad & & & × \quad & & × \quad \\ \hline \end{array}$
Exercice 4:
$1)$ Compléter les réactions chimiques suivantes:oxyde de fer
$ \text { Aluminium} + \text { Dioxygène } \rightarrow \ldots . . . . . . . . . . . . . . . .$
$ \text { fer} + \text { Dioxygène } \rightarrow \ldots . . . . . . . . . . . . . . . .$
$ \ldots . . . . . . . . . . . . . . . .+ \text { Dioxygène } \rightarrow \text { Oxyde de zinc }$
$ \ldots . . . . . . . . . . . . . . .+ \text { Dioxygène } \rightarrow \text { Oxyde de cuivre II }$
$2)$ Equilibrer les équtions chimiques suivantes :
$\ldots \ldots \mathrm{Al}+\ldots \mathrm{O}_{2} \rightarrow \ldots . . \mathrm{Al}_{2} \mathrm{O}_{3}$
$\ldots . . \mathrm{Fe}+\ldots \mathrm{O}_{2} \rightarrow \ldots . \mathrm{Fe}_{2} \mathrm{O}_{3} $
$\ldots . \mathrm{Cu}+\ldots \mathrm{O}_{2} \rightarrow \ldots . \mathrm{CuO} $
$\ldots \ldots \mathrm{Zn}+\ldots \mathrm{O}_{2} \rightarrow \ldots . \mathrm{ZnO}$
$1)$ Compléter les réactions chimiques suivantes:
$ \text { Aluminium} + \text { Dioxygène } \rightarrow \text { Oxyde d’aluminium }$
$ \text { Fer} + \text { Dioxygène } \rightarrow \text { Oxyde de fer III}$
$ \text { Zinc } + \text { Dioxygène } \rightarrow \text { Oxyde de zinc }$
$ \text { Cuivre } + \text { Dioxygène } \rightarrow \text { Oxyde de cuivre II }$
$2)$ Equilibrer les équtions chimiques suivantes :
$4 \mathrm{Al}+3 \mathrm{O}_{2} \rightarrow 2\mathrm{Al}_{2} \mathrm{O}_{3}$
$4\mathrm{Fe}+3 \mathrm{O}_{2} \rightarrow 2 \mathrm{Fe}_{2} \mathrm{O}_{3} $
$2\mathrm{Cu}+\mathrm{O}_{2} \rightarrow 2 \mathrm{CuO} $
$2 \mathrm{Zn}+ \mathrm{O}_{2} \rightarrow 2 \mathrm{ZnO}$
Exercice 5:
Lorsqu’un objet fabriqué en aluminium est abandonné à l’air libre, il subit une réaction chimique appelée oxydation de l’aluminium qui entraîne la formation d’une couche grisâtre et de formule chimique $\mathrm{Al}_{2} \mathrm{O}_{3}$, à la surface de l’objet.
$1)$ Quels sont les réactifs de cette réaction chimique?
$2)$ Ecrire l’équation bilan de la réaction chimique produisant $A l_{2} O_{3}$.
$3)$ L’oxydation de l’objet va-t-elle continuer jusqu’à la destruction totale de l’objet? Justifier ta réponse.
$1)$ $ \text { Aluminium} \quad et \text { Dioxygène }$
$2)$ $ \text { Aluminium} + \text { Dioxygène } \rightarrow \text { Oxyde d’aluminium }$
$3)$ Non, car l’alumine (oxyde d’aluminium) est un composé imperméable ce qui protège l’aluminium de la corrosion en profondeur.
Exercice 6:
Le fer intervient dans la composition de différents objets très utilisés dans la vie courante comme les portes et les fenêtres en fer forgé en raison de sa rigidité mais il s’expose à la corrosion dans l’air humide à cause de la rouille constituée essentiellement du corps composé de formule chimique $F e_{2} O_{3}$.
$1)$ Donner le nom du corps composé de formule chimique $F e_{2} O_{3}$
$2)$ Ecrire l’équation chimique bilan de la réaction chimique produisant $F e_{2} O_{3}$.
$3)$ Expliquer pourquoi, il est conseillé de protéger le fer dans les régions humides.
$4)$ Citer deux techniques utilisées pour la protection contre la corrosion du fer.
$1)$ $\text { Oxyde de fer III }$
$2)$ $ \text { Fer} + \text { Dioxygène } \rightarrow \text { Oxyde de fer III}$
$3)$ La rouille est une couche poreuse cette dernière laisse passer l’eau et l’air qui peuvent continuer à réagir avec le fer en profondeur jusqu’à la disparition totale du fer.
$4)$
* Le peint avec une peinture antirouille.
* Le recouvrir avec un autre métal (galvanisation).
Exercice 7:
On laisse une masse $\mathbf{m = 5 8 g}$ de la paille du fer dans l’air. Après quelques semaines, on observe la formation de la rouille.
La masse de la paille du fer devient $69g$.
$1)$ Donner les propriétés de la rouille ?
$2)$ Quel est le composé essentiel de la rouille, donner sa formule chimique.
$3)$ Quels sont les réactifs et les produits dans cette réaction chimique ?
$4)$ Comment appelons-nous cette réaction chimique.
$5)$ Écrire le bilan littéral de cette réaction chimique.
$6)$ Écrire l’équation équilibrée de cette réaction chimique.
$7)$ Calculer la masse $\mathbf{m}$ du corps qui a réagi avec le fer.
$1)$ Les propriétés de la rouille sont :
* Sa couleur est brun-rouge.
* C’est une substance poreuse (perméable au gaz et aux liquides).
$2)$ Le composé essentiel de la rouille est l’oxyde de fer III, sa formule chimique est : $\mathrm{Fe}_{2} \mathrm{O}_{3}$.
$3)$ Dans cette réaction chimique :
* Les réactifs sont : le fer et l’oxygène.
* Les produits sont : dioxyde de fer III.
$4)$ Nous appelons cette réaction chimique une réaction d’oxydation car l’un des réactifs et le dioxygène.
$5)$ Le bilan de cette réaction chimique est :
$\text { Fer }+ \text { dioxygène } \rightarrow \text { oxyde de fer III }$
$6)$ L’équation équilibrée de cette réaction chimique est :
$4 \mathrm{Fe}+3 \mathrm{O}_{2} \longrightarrow 2 \mathrm{Fe}_{2} \mathrm{O}_{3}$
$7)$ La masse du corps qui a réagi avec le fer (le dioxygène) est :
D’après la loi de la conservation de la masse, on a :
Alors : $m(\mathrm{Fe})+m\left(\mathrm{O}_{2}\right) =m\left(\mathrm{Fe}_{2} \mathrm{O}_{3}\right) $
$m\left(\mathrm{O}_{2}\right) =m\left(\mathrm{Fe}_{2} \mathrm{O}_{3}\right)-m(\mathrm{Fe}) $
A.N : $m\left(\mathrm{O}_{2}\right)= 69-58$
Donc: $m\left(O_{2}\right)=11 g$
Exercice 8:
$1)$ Expliquer pourquoi dans les villes côtières le fer est plus vite attaqué par la rouille en comparaison avec les villes qui sont loin de la mer.
$2)$ Citer 2 méthodes pour protéger le fer contre la corrosion.
$3)$ Expliquer pourquoi l’aluminium est utilisé sans peinture.
$4)$ L’un des alliages de l’aluminium est appelé Alpax avec la compostions : $13 \%$ de silicium et $87 \%$ d’aluminium.
$a)$ Qu’est-ce qu’un alliage.
$b)$ La carrosserie d’une voiture en Alpax pèse une tonne. Calculer la masse d’aluminium dans cette voiture en $Kg$.
$1)$ Le fer est plus vite attaqué par la rouille dans les villes côtières car dans ces villes l’air est plus humide à cause de l’augmentation de l’humidité, par contre l’air dans les villes qui sont loin de la mer l’air est moins humide (air sec).
$2)$ Pour protéger le fer contre l’action de l’air (la rouille) on peut:
* Le peint avec une peinture antirouille.
* Le recouvrir avec un autre métal (galvanisation).
* Le recouvrir avec une matière grasse.
$3)$ L’aluminium est utilisé sans peinture car l’oxydation de ce dernier produit une substance (oxyde d’aluminium) non poreuse (imperméable aux liquides et aux gaz) qui le protège.
$4)$
$a)$ L’alliage est le fait de mélanger un métal avec un autre métal ou autre substance dans le but d’augmenter la résistance de ce dernier à la corrosion.
$b)$ La carrosserie d’une voiture en Alpax pèse une tonne.
Calculons la masse de l’aluminium dans cette voiture en Kg :
On a: $\quad m=1 t$ la masse de la carrosserie de la voiture.
$=1000 \mathrm{Kg}$
Et on a: $\quad 1000 \mathrm{Kg} \rightarrow 100 \%$
$m(\text { aluminium }) \rightarrow 87 \%$
Alors : $m(\text { Aluminium })=\frac{1000 \times 87}{100} $
$=870 \mathrm{~g}$
Donc la masse d’aluminium dans cette carrosserie est : $m=870 \mathrm{~g}$
Exercice 9:
On abandonne une plaque métallique en aluminium dans l’air libre, cette dernière a subi une réaction chimique qui entraine la formation d’une couche gris foncé sur sa surface.
$1)$ Comment appelons-nous cette réaction chimique.
$2)$ Donner le nom de cette couche gris foncé et sa formule chimique.
$3)$ Donner les réactifs et les produits dans cette réaction chimique.
$4)$ Écrire l’équation chimique de cette réaction chimique.
$5)$ Donner l’équation équilibrée de cette réaction chimique
$6)$ La réaction cette plaque en aluminium va-t-elle continuer jusqu’à sa destruction ? justifier votre réponse.
$1)$ Nous appelons cette réaction chimique une réaction d’oxydation (car l’un des réactifs est le dioxygène).
$2)$ Le nom de cette couche gris foncé est : Oxyde d’aluminium (Alumine).
Sa formule chimique est : $\mathrm{Al}_{2} \mathrm{O}_{3}$
$3)$ Dans cette réaction chimique :
* Les réactifs sont : $\text { Aluminium + dioxygène }$
* Les produits sont : $\text { oxyde d’aluminium }$
$4)$ Le bilan de cette réaction chimique est :
$\text { Aluminium + dioxygène } \rightarrow \text { oxyde d’aluminium }$
$5)$ L’équation équilibrée de cette réaction chimique est : $\mathbf{4 A l}+\mathbf{3 O} \rightarrow \mathbf{2 A l _ { 2 } \mathbf { O } _ { 3 }}$
$6)$ La réaction de cette plaque en aluminium ne va pas continuer jusqu’à sa destruction car la couche d’oxyde d’aluminium formée est une couche non poreuse.
Oxydation des métaux dans l’air exercices corrigés
