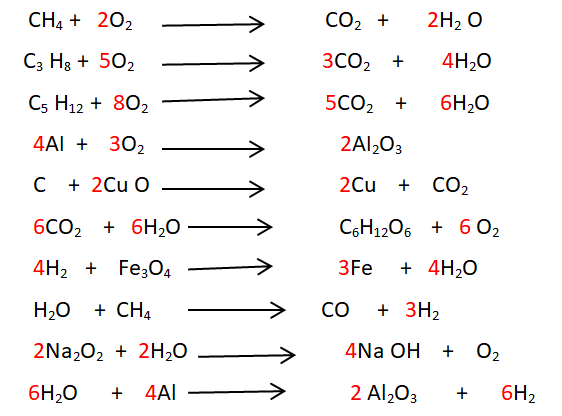
Réactions chimiques exercices corrigés destiné aux élèves de la deuxième année collège 2AC biof,pour progresser en physique chimie et doper votre niveau.
1- Cochez la case correspondante à la bonne réponse :

2- Placer les mots suivants dans la bonne place : chimique, réactifs, conservation de la masse, physique,
produits, réarrangent, réactifs, conservation des atomes, identiques, réactifs.
– Au cours d’une transformation …………………………. la masse des réactifs est égale à la masse des
………………….. c’est la loi de la …………………………………………………….
– Au cours d’une transformation chimique, les atomes des ………………….. se ……………………… pour
former les molécules des ……………………………………
– les atomes présents dans les produits sont ……………………………….. en type et en nombre aux atomes
présents dans les …………………………… c’est la loi de la ………………………………………………..
Cochez la case correspondante à la bonne réponse :

2- Placer les mots suivants dans la bonne place : chimique, réactifs, conservation de la masse, physique,
produits, réarrangent, réactifs, conservation des atomes, identiques, réactifs.
– Au cours d’une transformation chimique la masse des réactifs est égale à la masse des
produits c’est la loi de la conservation de la masse .
– Au cours d’une transformation chimique, les atomes des réactifs se réarrangent pour former les molécules des produits .
– les atomes présents dans les produits sont identiques en type et en nombre aux atomes présents dans les réactifs . c’est la loi de la conservation des atomes .
Compléter les phrases suivantes :
• Une réaction chimique est une transformation………………………au cours de laquelle des corps sont consommés appelés………………………….et d’autres corps sont formés appelés……………….…………. .
• Le bilan de la combustion du………………… dans le dioxygène est :
……………………….+ ………………. → oxyde de fer
• Lors d’une transformation chimique, la somme des ………………. des produits est ………………………. à celle des réactifs consommés .
• La combustion de 3 g de carbone nécessite 8 g de dioxygène ; il se forme alors ……. g de dioxyde de ……………… .
Compléter les phrases suivantes :
• Une réaction chimique est une transformation chimique au cours de laquelle des corps sont consommés appelés réactifs et d’autres corps sont formés appelés produits .
• Le bilan de la combustion du fer dans le dioxygène est :
Fer + Dioxygène → oxyde de fer
• Lors d’une transformation chimique, la somme des masses des produits est égale à celle des réactifs consommés .
• La combustion de 3 g de carbone nécessite 8 g de dioxygène ; il se forme alors 11 g de dioxyde de carbone .
L’aluminium (Al) réagit avec le dioxygène, pour former l’oxyde d’aluminium (Al2O3) .
• Donnez le bilan littéral de cette réaction .
………………………………………………………………………………………………
• Donnez l’équation bilan de cette réaction .
………………………………………………………………………………………………
L’aluminium (Al) réagit avec le dioxygène, pour former l’oxyde d’aluminium (Al2O3) .
• Donnez le bilan littéral de cette réaction .
Aluminium + Dioxygène → Oxyde d’aluminium
• Donnez l’équation bilan de cette réaction .
Al + O2 → Al2O3
La combustion de l’argent (Ag) dans le dioxygène conduit à la formation de l’oxyde d’argent Ag2O.
1- Indiquer les réactifs et leur formule chimique ?
2- Indiquer le nom du produit et sa formule chimique ?
3- Ecrire le bilan de la réaction ?
4- Écrire l’équation bilan traduisant cette réaction chimique ?
La combustion de l’argent (Ag) dans le dioxygène conduit à la formation de l’oxyde d’argent Ag2O.
1- les réactifs :
Argent (Ag)
Dioxygène (O2)
2- le nom du produit et sa formule chimique :
Oxyde d’argent (Ag2O)
3- Ecrire le bilan de la réaction ?
Argent + Dioxygène → Oxyde d’argent
4- Écrire l’équation bilan traduisant cette réaction chimique ?
Ag + O2 → Ag2O
La molécule du dioxyde de carbone a pour formule chimique : CO2 complète le tableau :
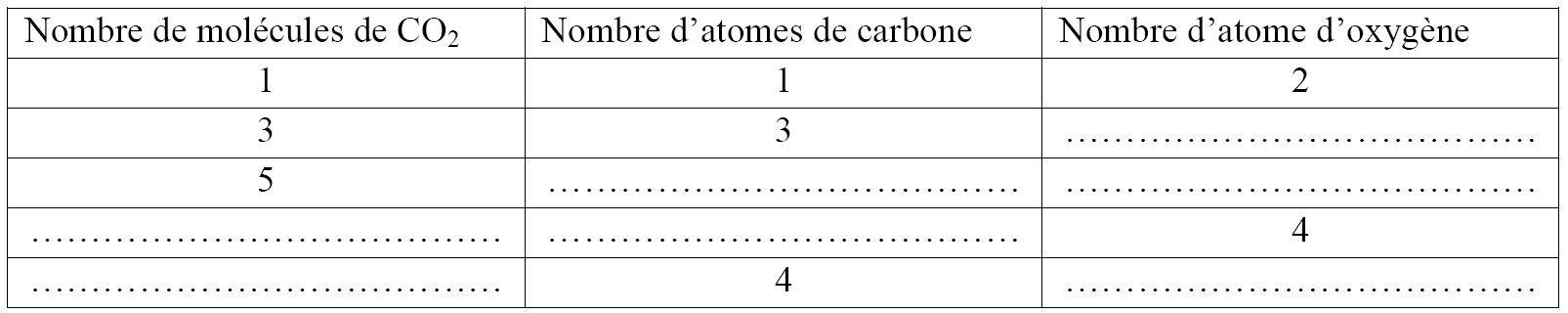
La molécule du dioxyde de carbone a pour formule chimique : CO2 complète le tableau :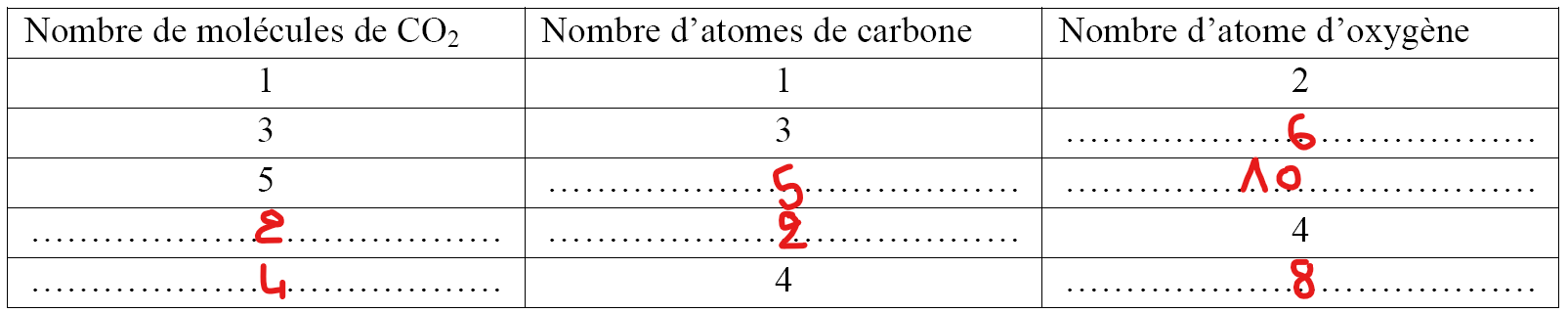
Entourer la bonne réponse
Avec 22 atomes de carbone et 40 atomes d’oxygène, on peut fabriquer :
a- 20 molécules de dioxyde de carbone
b- 22 molécules de dioxyde de carbone
c- 24 molécules de dioxyde de carbone
d- 40 molécules de dioxyde de carbone
Entourer la bonne réponse
Avec 22 atomes de carbone et 40 atomes d’oxygène, on peut fabriquer :
a- 20 molécules de dioxyde de carbone
b- 22 molécules de dioxyde de carbone
c- 24 molécules de dioxyde de carbone
d- 40 molécules de dioxyde de carbone
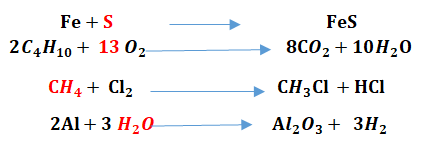
En appliquant les lois de la réaction chimique, équilibrés les équations suivantes :
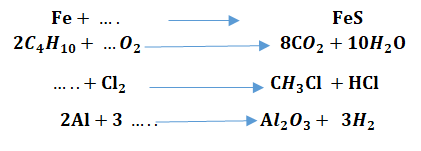
En appliquant les lois de la réaction chimique, équilibrés les équations suivantes :
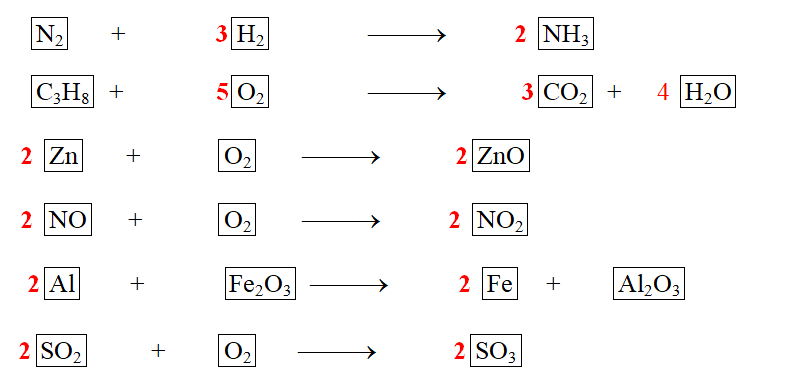
Equilibrer les équations chimiques de combustion suivantes en utilisant la loi de conservation des atomes :
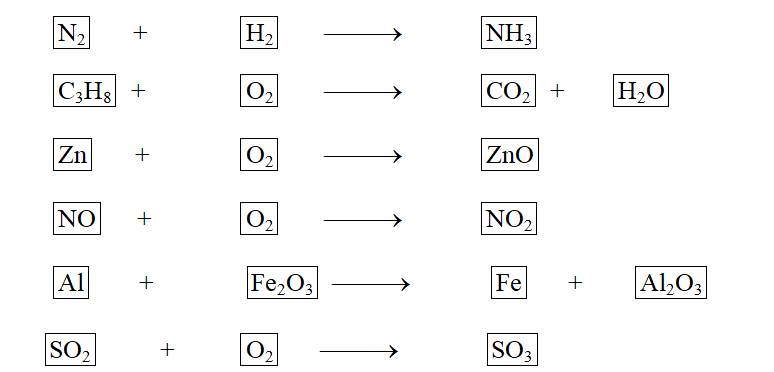
Equilibrer les équations chimiques de combustion suivantes en utilisant la loi de conservation des atomes :
Equilibrer les équations chimiques de combustion suivantes en utilisant la loi de conservation des atomes :
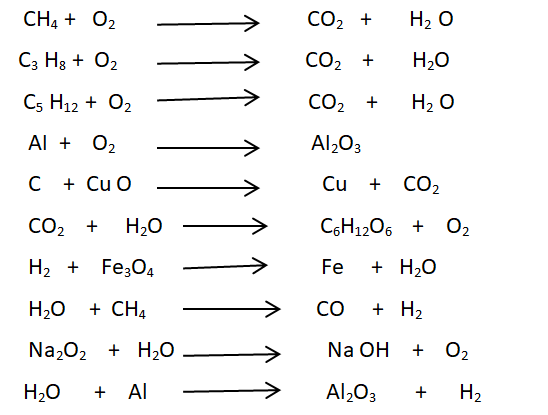
Equilibrer les équations chimiques de combustion suivantes en utilisant la loi de conservation des atomes :