Réactions de quelques métaux avec les solutions acides et basiques exercices corrigés
Réactions de quelques métaux avec les solutions acides et basiques
I. Action d’une solution d’acide chlorhydrique sur les métaux
Acide chlorhydrique est de formule ( $\mathrm{H}^{+}+\mathrm{Cl}^{-}$) contient des ions $\mathrm{H}^{+}$et des ions Cl
1. Expérience
On ajoute une quantité d’acide chloridrique à quatre tubes à essais contint des métaux et On approche une allumette enflammée de l’entrée du tube à essais.
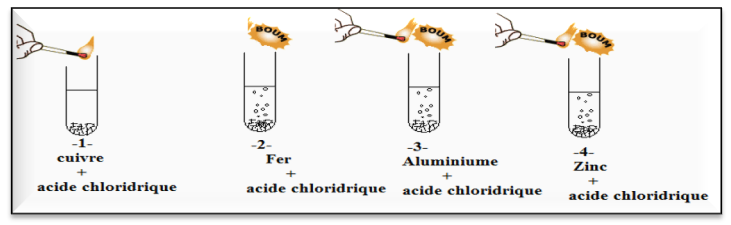
2. Observation et conclusion :
Ø Lorsqu’on ajoute de l’acide chlorhydrique dans les tubes $-1- ; -2- et -3-$ on observe un dégagement gazeux (réaction chimique)
Ø le gaz formé est du dihydrogène ( $\mathrm{H}_{2}$), il brûle lorsqu’on présente une allumette enflammée à l’extrémité du tube
Ø Lorsqu’on approche la flamme d’une allumette à proximité de l’ouverture des tubes à essai $-1- ; -2-et -3-$ on entend une détonation aigüe.
3. conclusion
Tube $-1-$
– il ne se produit rien dans le tube ou il y a le cuivre
Tube $-2-$
Ø Avant réaction :
• Du fer formé d’atomes de fer : $Fe$
• De l’acide chlorhydrique contenant les ions ($\mathrm{H}^{+}+\mathrm{Cl}^{-}$) venant d’atomes d’hydrogène et de chlore
Ø Après réaction :
Une solution chlorure de fer (II) + gaz
• Le fer disparaît et se transforme en ions aluminium ( $\mathrm{Fe}^{2+}$):
• Les ions chlorure n’ont pas réagi Les ions chlorure ($\mathrm{Cl}^{-}$) sont des ions spectateurs.
• La réaction est : $\text { Fer + acide chlorhydrique } \rightarrow \text { dihydrogène + chlorure de fer (II) }$
L’équation bilan de la réaction entre le fer et l’acide chlorhydrique
$\mathrm{Fe}+2\left(\mathrm{H}^{+}+\mathrm{Cl}^{-}\right)$————–> $\mathrm{H}_{2}+\left(\mathrm{Fe}^{2+}+2 \mathrm{Cl}^{-}\right)$
soit en enlevant les ions spectateurs : (l’équation simplifié)
$\mathrm{Fe}+2 \mathrm{H}^{+}$————–> $\mathrm{H}_{2}+\mathrm{\mathrm{Fe}^{2+}}$
Tube $-3-$
Ø L’aluminium disparaît et se transforme en ions aluminium ($\mathrm{Al^{3+}}$) :
Ø Les ions chlorure n’ont pas réagi Les ions chlorure ($\mathrm{Cl}^{-}$) sont des ions spectateurs.
$\text { Aluminium + acide chlorhydrique } \rightarrow \text { dihydrogène + chlorure d’aluminium }$
L’équation bilan de la réaction entre le fer et l’acide chlorhydrique
$2 \mathrm{Al}+6\left(\mathrm{H}^{+}+\mathrm{Cl}^{-}\right)$————–> $3 \mathrm{H}_{2}+2\left(\mathrm{Al}^{3+}+3 \mathrm{Cl}^{-}\right)$
soit en enlevant les ions spectateurs : (l’équation simplifié)
$2 \mathrm{Al}+6 \mathrm{H}^{+}$————–> $3 \mathrm{H}_{2}+2 \mathrm{Al}^{3+}$
Tube $-4-$
$\text {Zinc + acide chlorhydrique } \rightarrow \text { dihydrogène + chlorure de zinc }$
L’équation bilan de la réaction entre le fer et l’acide chlorhydrique
$\mathrm{ZN}+2\left(\mathrm{H}^{+}+\mathrm{Cl}^{-}\right)$————–> $\mathrm{H}_{2}+\left(\mathrm{Zn}^{2+}+2 \mathrm{Cl}^{-}\right)$
soit en enlevant les ions spectateurs : (l’équation simplifié)
$\mathrm{Zn}+2 \mathrm{H}^{+}$————–> $\mathrm{H}_{2}+\mathrm{Zn}^{2+}$
Conclusion :
• L’acide chlorhydrique réagit avec le fer, l’aluminium et le zinc mais ne réagit avec le cuivre.
• Les produits de la réaction sont le dihydrogène $H_{2}$ et l’ion métallique correspondantt
II. Action d’une solution d’hydroxyde de sodium sur les métaux
la soude (solution d’hydroxyde) de sodium solution basique de formule ( $\mathrm{Na}^{+}+\mathrm{OH}^{-}$)
1. Expérience :
On ajoute une quantité de soude à quatre tubes à essais contint des métaux et On approche une allumette enflammée de l’entrée du tube à essais.
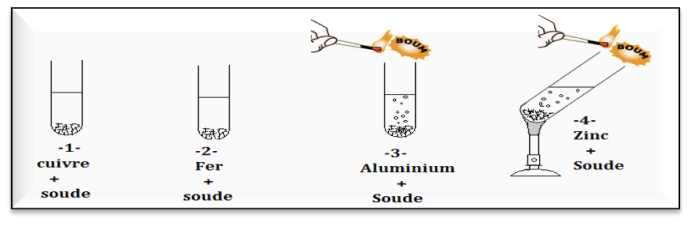
Observation et conclusion :
• Il n’y a pas de réaction de la soude avec le fer et le cuivre.
• L’aluminium réagit rapidement avec la soude alors que la réaction du zinc est plus lente, elle nécessite un chauffage.
• L’action de la soude sur l’aluminium et le zinc entraine la formation du gaz dihydrogène (provoque une détonation a proximité d’une flamme)
III. action des solutions acides et basiques sur les matériaux non métalliques
• les matières plastique ne réagissent pas en général avec les solutions acides et basiques.
• Les verres réagissent avec les solutions basiques très concentrées
• Les acides et les bases peuvent être stockés dans des récipients plastiques ou en verre .
Réactions de quelques métaux avec les solutions acides et basiques exercices corrigés
Exercice 1:
Indique si les affirmations suivantes sont vraies ou fausses. Justifie si possible.
$1)$ Le cuivre réagit avec l’acide chlorhydrique.
$2)$ Le dégagement gazeux observé lors de la réaction entre le zinc et l’acide chlorhydrique est du dioxygène.
$3)$ L’aluminium réagit avec la soude sans chauffage.
$4)$ Le fer ne réagit pas avec la soude.
$5)$ Les ions chlorure participent à la réaction chimique avec les métaux.
$1)$ Faux – Le cuivre ne réagit pas avec l’acide chlorhydrique.
$2)$ Faux – Le gaz formé est du dihydrogène .
$3)$ Vrai – L’aluminium réagit rapidement avec la soude sans besoin de chauffer.
$4)$ Vrai – Il n’y a pas de réaction entre la soude et le fer.
$5)$ Faux – Les ions chlorure sont spectateurs, ils ne participent pas à la transformation chimique.
Exercice 2:
Complète les phrases suivantes avec les mots proposés : $\mathrm{OH}^{-}$ ; Fer ; Cuivre ; $\mathrm{Na}^{+}$ ; dihydrogène ; $\mathrm{H}^{+}$ ; spectateure ; $\mathrm{Cl}^{-}$
$1)$ Le $……….$ réagit avec l’acide chlorhydrique en produisant du $……….$ .
$2)$ Les ions $……….$ de l’acide sont responsables des réactions avec les métaux.
$3)$ Le $……….$ ne réagit ni avec l’acide chlorhydrique, ni avec la soude.
$4)$ Les ions $……….$ sont dits $……….$ car ils ne changent pas pendant la réaction.
$5)$ La soude est une solution basique contenant les ions $……….$ et $……….$ .
$1)$ Le Fer réagit avec l’acide chlorhydrique en produisant du dihydrogène .
$2)$ Les ions $\mathrm{H}^{+}$ de l’acide sont responsables des réactions avec les métaux.
$3)$ Le cuivre ne réagit ni avec l’acide chlorhydrique, ni avec la soude.
$4)$ Les ions $\mathrm{Cl}^{-}$ sont dits spectateurs car ils ne changent pas pendant la réaction.
$5)$ La soude est une solution basique contenant les ions $\mathrm{Na}^{+}$ et $\mathrm{OH}^{-}$ .
Exercice 3:
Associer chaque réaction à son équation simplifiée Fais correspondre les couples suivants :
Réaction :
$A)$ Fer + acide chlorhydrique
$B)$ Aluminium + acide chlorhydrique
$C)$ Zinc + acide chlorhydrique
Équation simplifiée :
$1)$ $2 \mathrm{Al}+6 \mathrm{H}^{+}$————–> $3 \mathrm{H}_{2}+2 \mathrm{Al}^{3+}$
$2)$ $\mathrm{Fe}+2 \mathrm{H}^{+}$————–> $\mathrm{H}_{2}+\mathrm{\mathrm{Fe}^{2+}}$
$3)$ $\mathrm{Zn}+2 \mathrm{H}^{+}$————–> $\mathrm{H}_{2}+\mathrm{Zn}^{2+}$
$A)$ $\rightarrow $2)$
$B)$ $\rightarrow $1)$
$C)$ $\rightarrow $3)$
Exercice4:
Coche la (ou les) bonne(s) réponse(s).
$1)$ Quelle(s) observation(s) permet(tent) de prouver la formation de dihydrogène ?
– Une fumée blanche
– Une détonation à la flamme
– Une flamme qui s’éteint rapidement
$2)$ Parmi ces matériaux, lequel est le plus réactif avec la soude ?
– Fer
– Cuivre
– Aluminium
– Verre
$1)$ – Une détonation à la flamme
$2)$ Aluminium
Exercice 5:
Relier chaque terme à sa définition
$A$. Ion spectateur $\rightarrow$
$B$. Métal réducteur $\rightarrow$
$C$. Dihydrogène $\quad \rightarrow$
$D$. Solution basique $\rightarrow$
Définitions :
$1)$ Se transforme en ions lors d’une réaction chimique
$2)$ Ne change pas pendant la réaction
$3)$ Gaz inflammable qui provoque une détonation
$4)$ Contient des ions $\mathrm{OH}^{-}$
$A \rightarrow 2$
$B \rightarrow 1$
$C \rightarrow 3$
$D \rightarrow 4$
Exercice 6:
Remettre les étapes dans l’ordre logique d’une expérience Mets dans l’ordre les étapes d’une expérience pour tester l’action de l’acide chlorhydrique sur un métal :
$a)$ Observer si un dégagement gazeux se produit
$b)$ Approcher une allumette enflammée à l’entrée du tube
$c)$ Ajouter le métal dans le tube à essai
$d)$ Verser l’acide chlorhydrique
$e)$ Noter les résultats et conclure
$1. c)$
$2. d)$
$3. a)$
$4. b)$
$5. e)$
Exercice 7:
On verse dans un tube à essai un peu de limaille du fer. Ensuite, on ajoute de l’acide chlorhydrique dilué.
$1)$ Quel est le gaz dégagé au cours de cette réaction ?
$2)$ Si on approche une allumette enflammée à l’ouverture du tube à essai, que se passe-t-il ?
$3)$ Écrire l’équation équilibrée de cette réaction chimique.
$1)$ Gaz dégagé : le dihydrogène (\mathrm{H}_2)
$2)$ Une détonation se produit (petite explosion).
$3)$ $2)$ $\mathrm{Fe}+2 \mathrm{H}^{+}$————–> $\mathrm{H}_{2}+\mathrm{\mathrm{Fe}^{2+}}$
Exercice 8:
La solution d’acide chlorhydrique contient un ion commun à toutes les solutions acides.
$1)$ Donner le nom de cet ion et sa formule.
$2)$ On ajoute un peu d’acide chlorhydrique au Zinc. On constate l’émission d’un gaz.
$a)$ Donner le nom et la formule chimique du gaz dégagé.
$b)$ Comment on peut détecter la présence de ce gaz ?
$c)$ Écrire le bilan de la réaction du zinc avec la solution d’acide chlorhydrique.
$d)$ Écrire l’équation équilibrée de cette réaction chimique.
$1)$ Ion hydrogène : $\mathrm{H}^{+}$
$2-a)$ Gaz : dihydrogène $\mathrm{H}_{2}$
$2-b)$ Test : il explose au contact d’une flamme
$2-c)$ Bilan : $\mathrm{ZN}+2\left(\mathrm{H}^{+}+\mathrm{Cl}^{-}\right)$————–> $\mathrm{H}_{2}+\left(\mathrm{Zn}^{2+}+2 \mathrm{Cl}^{-}\right)$
$2-d)$ Équation équilibrée : $\mathrm{Zn}+2 \mathrm{H}^{+}$————–> $\mathrm{H}_{2}+\mathrm{Zn}^{2+}$
Exercice 9:
Soit l’équation chimique suivante qui traduit une transformation chimique :
$6\left(\mathrm{H}^{+}+\mathrm{Cl}^{-}\right)+2 \mathrm{Al} \rightarrow 3 \mathrm{H}_{2}+2\left(\mathrm{Al}^{3+}+3 \mathrm{Cl}^{-}\right)$
$1)$ Donner les noms des réactifs.
$2)$ Donner le composant qui n’a pas participé dans la réaction chimique.
$3)$ Écrire l’équation chimique simplifiée de cette réaction.
$1)$ Réactifs : acide chlorhydrique $(\mathrm{H}^{+}+\mathrm{Cl}^{-})$ et aluminium ( $Al$ )
$2)$ Le composant non participant : l’ion $\mathrm{Cl}^{-}$ (spectateur)
$3)$ Équation simplifiée : $2 \mathrm{Al}+6 \mathrm{H}^{+}$————–> $3 \mathrm{H}_{2}+2 \mathrm{Al}^{3+}$
Réactions de quelques métaux avec les solutions acides et basiques exercices corrigés
