L’étude des solutions acides et basiques en classe de 3ème revêt un intérêt majeur pour plusieurs raisons. Tout d’abord, cela permet aux élèves de comprendre un concept chimique fondamental : le pH.
Ils apprennent à mesurer et à évaluer l’acidité ou la basicité d’une solution en utilisant l’échelle de pH, ce qui est essentiel pour comprendre les réactions chimiques et biologiques.
Les solutions acides et les solutions basiques
I- Solution aqueuse
• Une solution est un mélange homogène obtenu par dissolution de soluté dans un solvant
• Une solution électriquement neutre si elle contient des cations. elle contient nécessairement aussi des anions
• Par exemple L’eau salée est une solution de chlorure de sodium contient des ions de chlorure et des ions sodium et le solvant et l’eau
• Pour distinguer entre les types des solutions aqueuse est lié à la prépondérance des ions et . ce caractère se déterminer par la mesure de pH de la solution (potentiel d’hydrogène).
¶- Exemples :

II- Notion de pH
Le taux d’ion d’hydrogène s’évalue en mesurant le pH (potentiel d’hydrogène) c’est une grandeur sans unité qui varier entre 0 et 14.
¶- Mesure de PH
Pour mesurer le pH d’une solution on utilise le papier pH ou pH-mètre.
a. La papier pH : on dépose une goute de solution sur un morceau de papier pH. et on compare sa couleur avec le nuancier de la boite et note le pH correspondant.
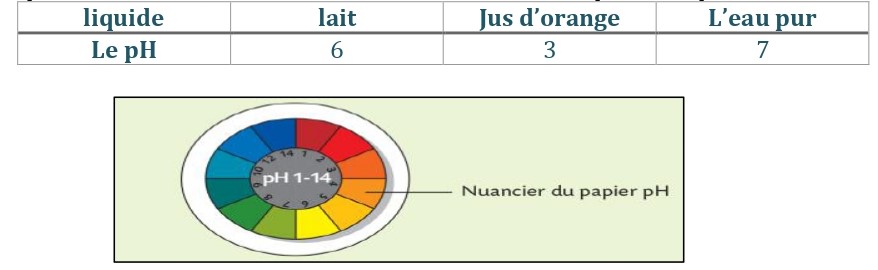
b. Le pH mètre
Emerge l’extrémité de la sonde de pH-mètre dans la solution.
après quelques instant noté le Ph

• Le pH solution aqueuse est grandeur sans unité qui varier entre 0 et 14 .
• On peut connaitre le caractère acide. basique ou neutre d’une solution en mesurant son pH à l’aide d’un papier pH ou pH-mètre .
III- les solution acides et basiques :
1. Expérience :
• On mesure le pH des solutions avec le papier ph et on trouve les résultats suivants :

2- Conclusion
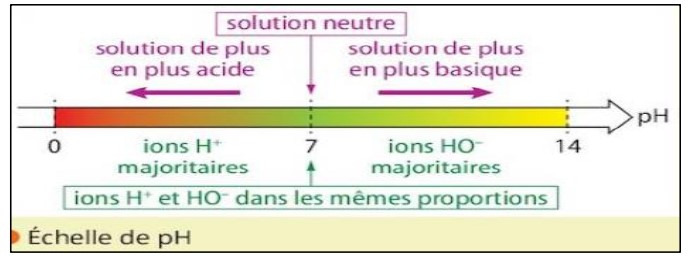
On classe les solutions en trois types selon le pH :
· si le pH est inférieur à 7 (pH ˂ 7) la solution est acide (pH est compris entre 0 et 7 )
· si le pH est supérieur à 7 (pH ˃ 7) la solution est basique (pH est compris entre 7et 14 )
· si le pH est égal à 7 (pH = 7) la solution est neutre.
Remarque :
• Une solution acide contient plus d’ions Hydrogène H+ que d’ions hydroxyle HO ̶ .
• Une solution basique contient moins d’ions Hydrogène H+ que d’ions hydroxyle HO ̶
• Une solution neutre contient autant d’ions Hydrogène H+ que d’ions hydroxyle HO ̶
IV- Dilution d’une solution aqueuse :
1. Expérience :
· On mesure le pH d’une solution aqueuse acide
· Et on ajoute l’eau de la solution
· Puis en mesure le pH de la solution
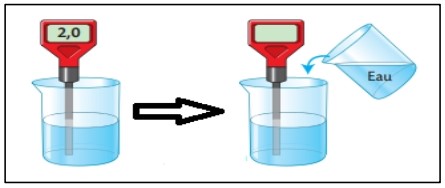
2. Observation et conclusion :
· Lorsque on ajute l’eau a une solution aqueuse acide la valeur de pH augmente(dilution de solution )
· Les solutions acides ou basiques présentent des dangers pour la santé et sur l’environnement .il faut les dilués avant les utilisés.
· La dilution d’une solution aqueuse consiste à ajouter de l’eau à cette solution et il ne faut jamais ajouté de l’eau à un acide concentré, car il provoque une projection de gouttelettes d’acide.
• Quand on dilue une solution acide, l’acidité diminue et la valeur du pH augmente et se rapproche de 7.
• Quand on dilue une solution basique, la basicité diminue et la valeur du pH diminue et se rapproche de 7.
V- Dangerosité des solutions acides et basiques :
· Le contact avec des acides ou des bases concentrées peut provoquer des dangers la santé et l’environnement (des brûlures de la peau, des muqueuses et des yeux……)

Lors de l’utilisation des solutions acides ou basiques il est nécessaire de respecter des consignes de sécurités comme :
· Lire attentivement les étiquettes des produits avant de les utiliser.
· Diluée une solutions avant de l’utiliser.
· Porter un vêtement de protection (une blouse), des lunettes de protection, des gants ; des masques.
· Eviter de goûter les solutions ou de respirer les vapeurs
· Lors de la dilution il faut ajouter ces solutions à l’eau et ne pas l’inverse.
Voir aussi
