Tests de reconnaissance de quelques ions exercices corrigés
Tests de reconnaissance de quelques ions exercices corrigés
I – Test de reconnaissance de l’ion chlorure $\mathbf{C \ell}^{-}$.
1 ) Expérience :
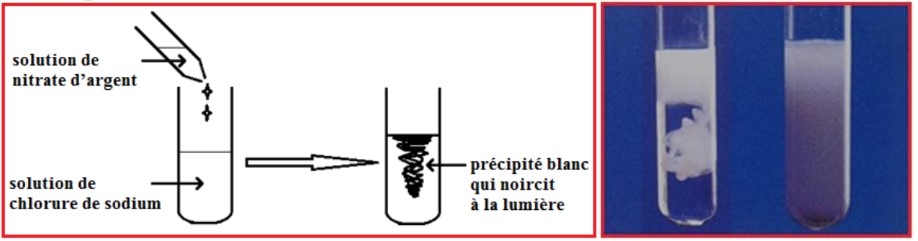
2 ) Observation et interprétation :
– Lorsque l’on verse quelques gouttes de la solution de nitrate d’argent ( $\mathrm{Ag}^{+}+\mathrm{NO}_{3}{ }^{-}$) dans une solution contenant des ions chlorure $\mathrm{Cl}^{-}$(solution de chlorure de sodium ( $\mathrm{Na}^{+}+\mathrm{Cl}^{-}$) par exemple), il se forme un précipité blanc de chlorure d’argent AgCl qui noircit à la lumière.
– Cette réaction constitue le test de reconnaissance des ions chlorure $\mathrm{Cl}^{-}$.
– L’équation de la réaction de précipitation est : $\mathrm{Ag}^{+}+\mathrm{Cl}^{-} \longrightarrow\underbrace{(\mathrm{AgCl})}_{\downarrow} $
$>$ Conclusion :
– Le nitrate d’argent est le réactif qui permet d’identifier les ions chlorure $\mathbf{C l}^{\boldsymbol{-}}$ en solution. On obtient un précipité blanc qui noircit à la lumière.
II – Tests de reconnaissance des ions métalliques.
1 ) L’ion cuivre II ( $\mathrm{Cu}^{2+}$ ).
a) Expérience :
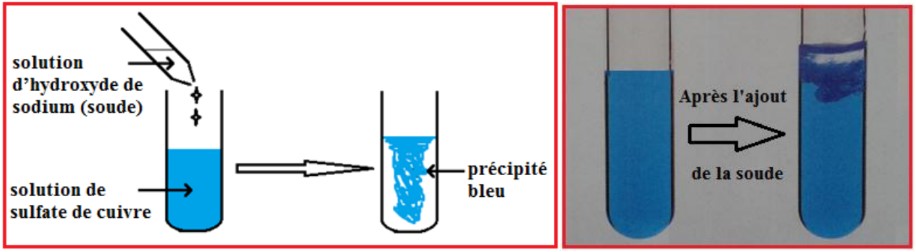
b ) Observation et interprétation :
– Lorsque l’on ajoute quelques gouttes de solution d’hydroxyde de sodium (soude) $\left(\mathrm{Na}^{+}+\mathrm{HO}^{-}\right)$dans une solution contenant des ions cuivre II Cu ${ }^{2+}$ (solution de sulfate de cuivre ( $\mathrm{Cu}^{2+}+\mathrm{SO}_{4}{ }^{2-}$ ) par exemple), il se forme un précipité bleu d’hydroxyde de cuivre II Cu (OH) ${ }_{2}$.
– Cette réaction constitue le test de reconnaissance des ions cuivre II $\mathrm{Cu}^{2+}$.
– L’équation de la réaction de précipitation est : $\mathrm{Cu}^{2+}+2 \mathrm{HO}^{-} \longrightarrow \underbrace{\mathrm{Cu}(\mathrm{OH})_{2}}_{\downarrow}$
2 ) L’ion fer II ( $\mathrm{Fe}^{2+}$ ) (ion ferreux).
a) Expérience :
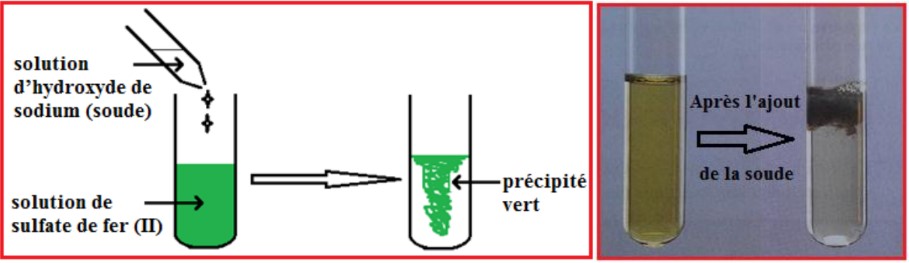
b ) Observation et interprétation :
– Lorsque l’on ajoute quelques gouttes de solution d’hydroxyde de sodium (soude) $\left(\mathrm{Na}^{+}+\mathrm{HO}^{-}\right)$dans une solution contenant des ions fer II Fe ${ }^{2+}$ (solution de sulfate de fer II ( $\mathrm{Fe}^{2+}+\mathrm{SO}_{4}{ }^{2-}$ ) par exemple), il se forme un précipité vert d’hydroxyde de fer II Fe $(\mathrm{OH})_{2}$.
– Cette réaction constitue le test de reconnaissance des ions fer II Fe ${ }^{2+}$.
– L’équation de la réaction de précipitation est : $\mathrm{Fe}^{2+}+2 \mathrm{HO}^{-} \longrightarrow \underbrace{\mathrm{Fe}(\mathrm{OH})_{2}}_{\downarrow}$
3) L’ion fer III ( $\mathrm{Fe}^{3+}$ ) (ion ferrique).
a) Expérience :
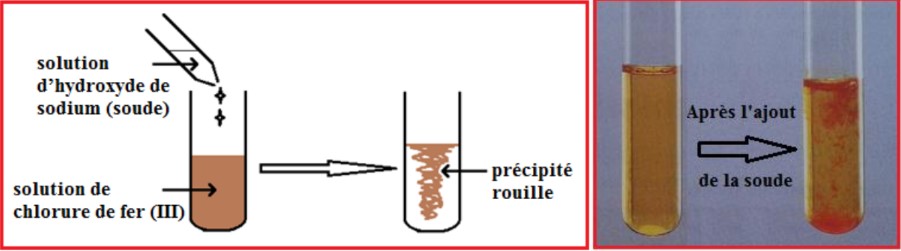
b ) Observation et interprétation :
– Lorsque l’on ajoute quelques gouttes de solution d’hydroxyde de sodium (soude) $\left(\mathrm{Na}^{+}+\mathrm{HO}^{-}\right)$dans une solution contenant des ions fer III Fe ${ }^{3+}$ (solution de chlorure de fer III ( $\mathrm{Fe}^{3+}+3 \mathrm{Cl}^{-}$) par exemple), il se forme un précipité rouille d’hydroxyde de fer III Fe (OH) ${ }_{3}$.
– Cette réaction constitue le test de reconnaissance des ions fer III Fe ${ }^{3+}$.
– L’équation de la réaction de précipitation est : $\mathrm{Fe}^{3+}+3 \mathrm{HO}^{-} \longrightarrow \underbrace{\mathrm{Fe}(\mathrm{OH})_{3}}_{\downarrow}$
4) L ‘ ion Zinc $ \mathrm{Zn}^{2+}$.
a) Expérience :
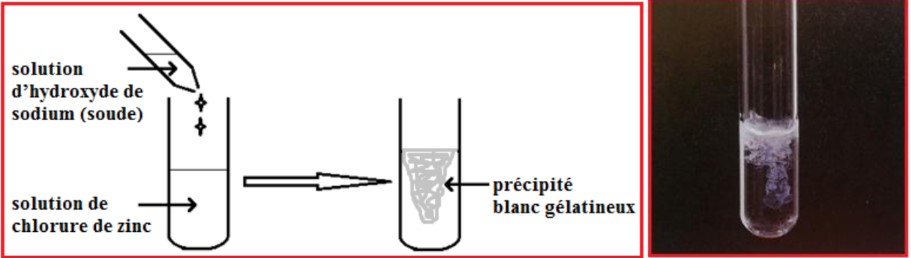
b ) Observation et interprétation :
– Lorsque l’on ajoute quelques gouttes de solution d’hydroxyde de sodium (soude) $\left(\mathrm{Na}^{+}+\mathrm{HO}^{-}\right)$dans une solution contenant des ions zinc $\mathrm{Zn}^{2+}$ (solution de chlorure de zinc ( $\mathrm{Zn}^{2+}+2 \mathrm{Cl}^{-}$) par exemple), il se forme un précipité blanc gélatineux d’hydroxyde de zinc $\mathrm{Zn}(\mathrm{OH})_{2}$.
– Cette réaction constitue le test de reconnaissance des ions zinc $\mathrm{Zn}^{2+}$.
– L’équation de la réaction de précipitation est : $\mathrm{Zn}^{2+}+2 \mathrm{HO}^{-} \longrightarrow \underbrace{\mathrm{Zn}(\mathrm{OH})_{2}}_{\downarrow}$
5 ) L’ion aluminium $\mathrm{Al}^{3+}$.
a) Expérience :
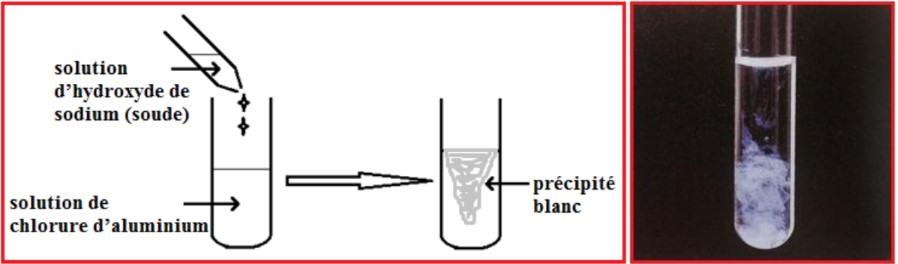
b ) Observation et interprétation :
– Lorsque l’on ajoute quelques gouttes de solution d’hydroxyde de sodium (soude) $\left(\mathrm{Na}^{+}+\mathrm{HO}^{-}\right)$dans une solution contenant des ions aluminium $\mathrm{Al}^{3+}$ (solution de chlorure $d$ ‘aluminium ( $\mathrm{Al}^{3+}+3 \mathrm{C} \ell^{-}$) par exemple), il se forme un précipité blanc d’hydroxyde d’aluminium $\mathrm{A} \ell(\mathrm{OH})_{3}$.
– Cette réaction constitue le test de reconnaissance des ions aluminium $\mathrm{Al}^{3+}$.
– L’équation de la réaction de précipitation est : $\mathrm{Al}^{3+}+3 \mathrm{HO}^{-} \longrightarrow \underbrace{\mathrm{Al}(\mathrm{OH})_{3}}_{\downarrow}$
Remarques :
– Le précipité blanc gélatineux (hydroxyde de zinc) formé avec l’ion $\mathrm{Zn}^{2+}$ est soluble dans un excès de soude et aussi dans un excès d’ammoniac.
– Le précipité blanc (hydroxyde d’aluminium) formé avec l’ion $\mathrm{Al}^{3+}$ est soluble dans un excès de soude et insoluble dans un excès d’ammoniac.
Conclusion :
– La solution d’hydroxyde de sodium (soude) est un réactif caractéristique utilisé dans la détection des ions cuivre (II) $\mathrm{Cu}^{2+}$, fer (II) $\mathrm{Fe}^{2+}$, fer (III) $\mathrm{Fe}^{3+}$, zinc $\mathrm{Zn}^{2+}$ et aluminium $\mathrm{Al}^{3+}$.
– Un test de reconnaissance par précipitation est basée sur la transformation chimique qui a lieu entre deux ions pour former un solide appelé précipité.
III – Test de reconnaissance de l’ion sodium $\mathrm{Na}^{+}$. (facultative)
1 ) Expérience :
On trempe un fil métallique de fer ou de cuivre ou du platine dans une solution d’hydroxyde de sodium ( $\mathrm{Na}^{+}+\mathrm{HO}^{-}$) et on le place dans une flamme bleue d’un bec bunsen.

2 ) Observation :
– La flamme prend une teinte jaune quand le fil de fer a été trempé dans la solution d’hydroxyde de sodium.
3 ) Interprétation :
– La couleur jaune de la flamme est caractéristique des ions sodium $\mathrm{Na}^{+}$.
Tests de reconnaissance de quelques ions exercices corrigés
Exercice 1:
$1)$ Répond par vrai ou faux :
$a)$ précipité de couleur blanche qui noircie à la lumière confirme la présence des ions de chlorure Cl-.
$b)$ précipité de couleur vert confirme la présence des ions de fer III $\mathrm{Fe}^{3+}$.
$c)$ précipité de couleur vert confirme la présence des ions de cuivre $C u^{2+}$
$2)$ compléter les phrases:
$a)$ le gaz du $……….$ de formule chimique $……….$ brûle lorsqu’on présente une allumette enflammée à l’extrémité du tube
$b)$ l’acide chlorhydrique réagit avec les métaux : $……….$ .et $……….$ et le $……….$ mais ne réagit avec $……….$
$c)$ hydroxyde de sodium réagit avec les métaux: $……….$ et $……….$ et ne réagit pas avec les métaux $……….$ et $……….$
$1)$
$a)$ Vrai
$b)$ Faux
$c)$ Faux
$2)$
$a)$ le gaz du dihydrogène de formule chimique $\mathrm{H}_{2}$ brûle lorsqu’on présente une allumette enflammée à l’extrémité du tube
$b)$ l’acide chlorhydrique réagit avec les métaux : Zinc .et Fer et L’aluminium mais ne réagit avec Cuivre
$c)$ hydroxyde de sodium réagit avec les métaux: Aluminium et Zinc et ne réagit pas avec les métaux Cuivre et Fer
Exercice 2:
$1)$ Associez chaque solution à sa formule chimique correspondante :
¤ Les solutions :
• Hydroxyde de sodium
• Nitrate d’argent
• Chlorure de zinc
• Chlorure de fer III
• Chlorure d’aluminium
• Sulfate de cuivre
• Sulfate de fer II
¤ Les formules chimiques :
• $\left(\mathrm{Na}^{+}+\mathrm{HO}^{-}\right)$
• $\left(\mathrm{Ag}^{+}+\mathrm{NO}_{3}^{-}\right.$
• $\left(\mathrm{Cu}^{2+}+\mathrm{SO}_{4}^{2-}\right)$
• $\left(\mathrm{Fe}^{2+}+\mathrm{SO}_{4}^{2-}\right)$
• $\left(\mathrm{Fe}^{3+}+3 \mathrm{Cl}^{-}\right)$
• $\left(\mathrm{Zn}^{2+}+2C l^{-}\right.$
• $\left(\mathrm{Al}^{3+}+3 \mathrm{Cl}^{-}\right)$
$\left(\mathrm{Ag}^{+}+\mathrm{NO}_{3}^{-}\right) \rightarrow$ Nitrate d’argent
$\left(\mathrm{Na}^{+}+\mathrm{HO}^{-}\right) \rightarrow$ Hydroxyde de sodium
$\left(\mathrm{Cu}^{2+}+\mathrm{SO}_{4}^{2-}\right) \rightarrow$ Sulfate de cuivre
$\left(\mathrm{Fe}^{3+}+3 \mathrm{Cl}^{-}\right) \rightarrow$ Chlorure de fer III
$\left(\mathrm{Fe}^{2+}+\mathrm{SO}_{4}^{2-}\right) \rightarrow$ Sulfate de fer II
$\left(\mathrm{Zn}^{2+}+2C l^{-}\right) \rightarrow$ Chlorure de zinc
$\left(\mathrm{Al}^{3+}+3 \mathrm{Cl}^{-}\right) \rightarrow$ Chlorure d’aluminium
Exercice 3:
Compléter le tableau :
$\begin{array} {|r|r|}\hline Ion \quad \quad & Formule \quad chimique \\ \hline sodium \quad & \ldots \ldots \ldots \ldots . . . . . . . . . \\ \hline chlorure \quad & \ldots \ldots \ldots \ldots . . . . . . . . . \\ \hline \ldots . . . . . . . . . & \mathrm{Cu}^{2+} \quad \quad \\ \hline Fer \quad II \quad & \ldots \ldots \ldots \ldots . . . . . . . . . \\ \hline \ldots . . . . . . . . . & F e^{3+} \quad \quad \\ \hline \end{array}$
$\begin{array} {|r|r|}\hline Ion \quad \quad & Formule \quad chimique \\ \hline sodium \quad & \mathrm{Na}^{+} \quad \quad \\ \hline chlorure \quad & \mathrm{Cl}^{-} \quad \quad \\ \hline Cuivre \quad II & \mathrm{Cu}^{2+} \quad \quad \\ \hline Fer \quad II \quad & \mathrm{Fe}^{2+} \quad \\ \hline Fer \quad III & F e^{3+} \quad \quad \\ \hline \end{array}$
Exercice4:
Karim à réaliser les expériences suivantes :
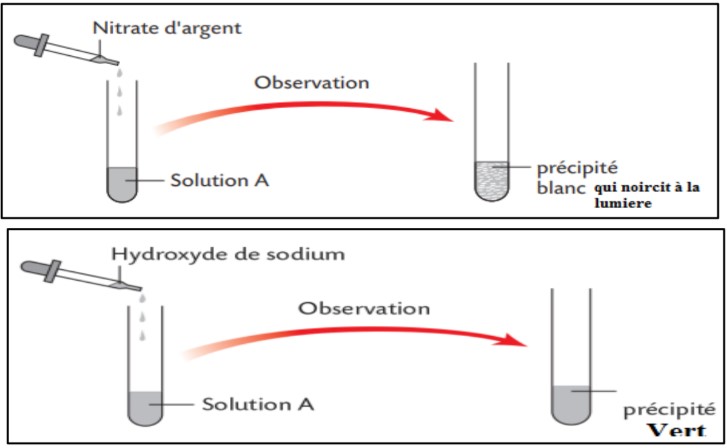
$1)$ Donner formule chimique de solution de nitrate d’argent
$2)$ Donner formule chimique de solution d’hydroxyde de sodium
$3)$ Quelles conclusions peut tu-tirer des observations de Karim dans l’expérience $1$
$4)$ Quelles conclusions peut tu-tirer des observations de Karim dans l’expérience $2$
$1)$ $\mathrm{Ag}^{+}+\mathrm{NO}_{3}^{-}$
$2)$ $\mathrm{Na}^{+}+\mathrm{OH}^{-}$
$3)$ Expérience $1 \rightarrow$ Présence de $\mathrm{Cl}^{-}$ (précipité blanc noircit à la lumière)
$4)$ Expérience $2 \rightarrow$ Présence de $\mathrm{Fe}^{2+}$ (précipité vert)
Exercice 5:
Khalid à réaliser les expériences suivantes :
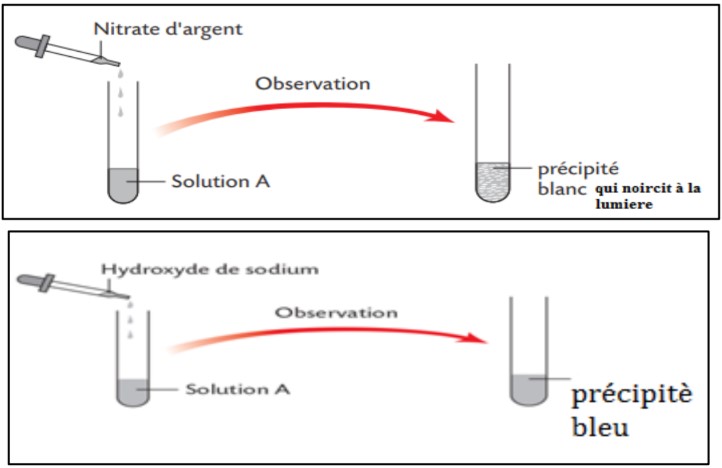
$1)$ Quelles conclusions peut tu-tirer des observations de Khalid dans l’expérience $1$
$2)$ Quelles conclusions peut tu-tirer des observations de Khalid dans l’expérience $2$
$2)$ Expérience $1 \rightarrow$ Présence de $\mathrm{Cl}^{-}$ (précipité blanc noircit à la lumière)
$2)$ Expérience $2 \rightarrow$ Présence de $\mathrm{Cu}^{2+}$ (précipité Bleu)
Exercice 6:
On introduit $2$ plaques métalliques $\mathbf{A}$ et $\mathbf{B}$ dans 2 béchers contenant une solution d’acide chlorhydrique.
On observe l’émission d’un gaz dans le bécher qui contient la plaque $A$, par contre rien ne se produit dans l’autre bécher.
$1)$ Donner le nom du gaz produit.
$2)$ On ajoute des gouttes de la solution de soude dans le bécher qui contient la plaque $A$ et on observe la formation d’un précipité gélatineux blanc.
$a)$ Donner le nom de ce précipité.
$b)$ En déduire le métal formant la plaque $A$ .
$3)$ La plaque $B$ est caractérisée par une couleur rouge brique, quel est le métal qui constitue cette plaque?
$1)$ Gaz produit : dihydrogène $H_{2}$
$2-a)$ Précipité : hydroxyde de zinc $\mathrm{Zn}(\mathrm{OH})_{2}$
$2-b)$ Métal $A$ : Zinc
$3)$ Métal $B$ (couleur rouge brique) : Cuivre
Exercice 7:
Une plaque d’aluminium réagit avec une quantité d’acide chlorhydrique en produisant un gaz incolore qui détonne à l’approche d’une flamme.
$1)$ Quel est le nom et la formule chimique du gaz produit?
$2)$ On ajoute à la solution obtenue des gouttes de soude et on observe la formation d’un précipité blanc.
$a)$ Donner le nom du précipité blanc.
$b)$ En déduire le nom et la formule chimique de l’ion détecté.
$3)$ Écrire le bilan de la réaction d’aluminium avec la solution d’acide chlorhydrique.
$4)$ Écrire l’équation équilibrée de la précipitation.
$1)$ Gaz dégagé : le dihydrogène (\mathrm{H}_2)
$2-a)$ Précipité : hydroxyde d’aluminium $\mathrm{Al}(\mathrm{OH})_{2}$
$2-b)$ Ion aluminium $\mathrm{Al^{3+}}$
$3)$ $2 \mathrm{Al}+6 \mathrm{H}^{+}$————–> $3 \mathrm{H}_{2}+2 \mathrm{Al}^{3+}$
$4)$ $\mathrm{Al}^{3+}+3 \mathrm{HO}^{-} \longrightarrow \underbrace{\mathrm{Al}(\mathrm{OH})_{3}}_{\downarrow}$
Exercice 8:
Soit une solution (S) contenant 2 ions. Afin d’identifier ces 2 ions:
A. On ajoute, à une quantité de cette solution, un peu de la soude ( $\mathrm{Na}^{+}+\mathrm{OH}^{-}$) et on observe la formation d’un précipité de couleur rouille.
1) Donner le nom et la formule moléculaire du précipité.
2) Écrire l’équation de la réaction chimique de précipitation.
3) En déduire le nom de l’ion détecté et donner son symbole.
B. On ajoute à l’autre quantité de la solution ( S ) des gouttes de nitrate d’argent ( $\mathrm{Ag}^{+}+\mathrm{NO}_{3}^{-}$) et on observe la formation d’un précipité blanc qui noircit à la lumière.
1) Donner le nom et la formule moléculaire du précipité blanc.
2) Écrire l’équation de la réaction chimique de précipitation.
3) En déduire le nom de l’ion détecté et donner son symbole.
C. A partir des deux expériences A et B donner le nom et la formule ionique de la solution $(\mathrm{S})$.
$1)$ Ion hydrogène : $\mathrm{H}^{+}$
$2-a)$ Gaz : dihydrogène $\mathrm{H}_{2}$
$2-b)$ Test : il explose au contact d’une flamme
$2-c)$ Bilan : $\mathrm{ZN}+2\left(\mathrm{H}^{+}+\mathrm{Cl}^{-}\right)$————–> $\mathrm{H}_{2}+\left(\mathrm{Zn}^{2+}+2 \mathrm{Cl}^{-}\right)$
$2-d)$ Équation équilibrée : $\mathrm{Zn}+2 \mathrm{H}^{+}$————–> $\mathrm{H}_{2}+\mathrm{Zn}^{2+}$
Exercice 9:
On verse une quantité de la soude dans une solution (S) et on observe la formation d’un précipité blanc gélatineux.
1) Donner le nom du précipité et sa formule chimique.
2) Donner le nom de l’ion détecté et son symbole.
3) Quel est l’ion détecteur ?
4) Écrire l’équation chimique de la précipitation.
$3)$ Écrire l’équation chimique simplifiée de cette réaction.
$1)$ Réactifs : acide chlorhydrique $(\mathrm{H}^{+}+\mathrm{Cl}^{-})$ et aluminium ( $Al$ )
$2)$ Le composant non participant : l’ion $\mathrm{Cl}^{-}$ (spectateur)
$3)$ Équation simplifiée : $2 \mathrm{Al}+6 \mathrm{H}^{+}$————–> $3 \mathrm{H}_{2}+2 \mathrm{Al}^{3+}$
Exercice 10:
Afin de préparer une solution $(S)$, on verse une quantité de poudre d’un métal $X$ dans un tube à essai qui contient une solution Y. on constate qu’un gaz se dégage.
1) Quel est le gaz dégagé et sa formule chimique ?
2) Comment on peut détecter ce gaz ?
On réalise 2 manipulations :
* Manipulation 1: on verse une quantité de la solution du nitrate d’argent dans la solution (Y), on observe la formation d’un précipité blanc qui noircit à la lumière.
1) Donner le nom du précipité qui se forme et sa formule chimique.
2) Donner la formule ionique de la solution du nitrate d’argent.
3) Quel est l’ion détecté, donner sa formule chimique.
4) Écrire l’équation chimique de la précipitation.
5) En déduire le nom de la solution $Y$ et donner sa formule chimique.
* Manipulation 2: on verse une quantité de la solution de soude dans la solution (S), on observe la formation d’un précipité blanc.
1) Donner le nom du précipité qui se forme et sa formule chimique.
2) Déterminer l’ion détecteur.
3) Écrire l’équation chimique de la précipitation.
4) En déduire le nom de la solution $X$ et donner sa formule chimique.
5) En déduire la nature du métal $X$.
6) Écrire l’équation simplifier de la réaction d’acide chlorhydrique avec le métal $X$.
$1)$ Réactifs : acide chlorhydrique $(\mathrm{H}^{+}+\mathrm{Cl}^{-})$ et aluminium ( $Al$ )
$2)$ Le composant non participant : l’ion $\mathrm{Cl}^{-}$ (spectateur)
$3)$ Équation simplifiée : $2 \mathrm{Al}+6 \mathrm{H}^{+}$————–> $3 \mathrm{H}_{2}+2 \mathrm{Al}^{3+}$
Tests de reconnaissance de quelques ions exercices corrigés
