Les états physiques de la matière
Les états physiques de la matière qui nous entoure peut se présenter sous trois états physiques différents : on distingue les solides, les liquides et les gaz.
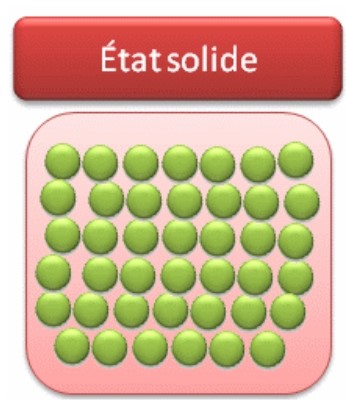
I- Etat solide
1- Propriétés d’un solide
Les solides sont :
Des solides compacts : ses corps ont des grandes dimensions et une forme propre. Ils ne se déforment pas, leur volume est donc constant.
Exemple : une table, un livre, un morceau de sucre.
Solides non compacts : ses corps ont des petites dimensions finies, ils peuvent être saisis avec les doigts et prennent la forme du récipient qui les contient. Donc ils n’ont pas de volume propre.
Exemple : sucre semoule, café moulu
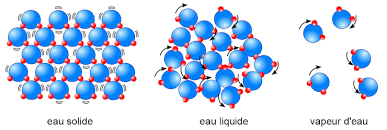
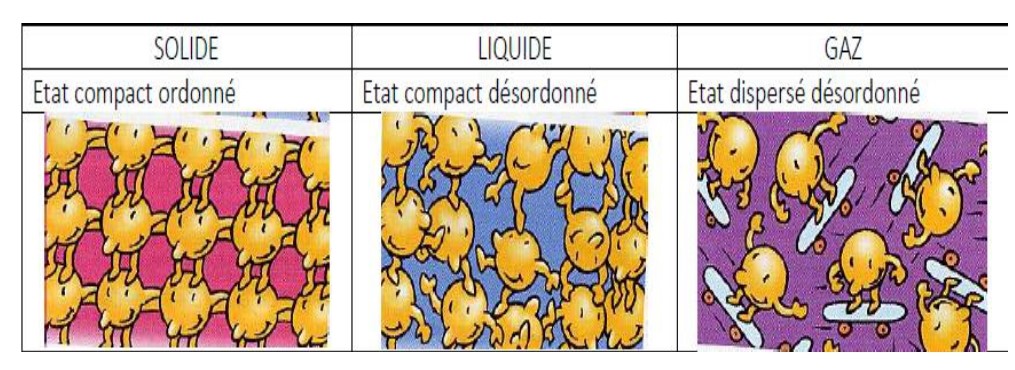
2- Modèle moléculaire des solides
Les particules d’un solide sont très proches les unes des autres et immobiles. Les particules sont liées entres elles.
L’état solide est un état compact et ordonné.
II- Etat Liquide
1- Définition
La surface libre d »un liquide contenu dans un récipient est la surface qui est en contact avec l’air.
2- Propriétés d’un liquide
On ne peut pas saisir un liquide avec nos doigts. Il prend la forme du récipient qui le contient. Les liquides n’ont pas une forme propre (elle dépend du récipient). La surface libre d’un liquide au repos est plane et horizontale
3- Modèle moléculaire des liquides
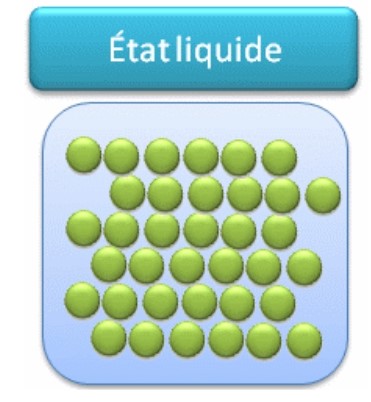
Les particules d’un liquide sont proches les unes des autres et agitées. Les particules sont faiblement liées et peuvent glisser les unes sur les autres : écoulement des liquides. L’état liquide est compact et désordonné. ( on dit aussi peu ordonné)
III- Etat Gazeux
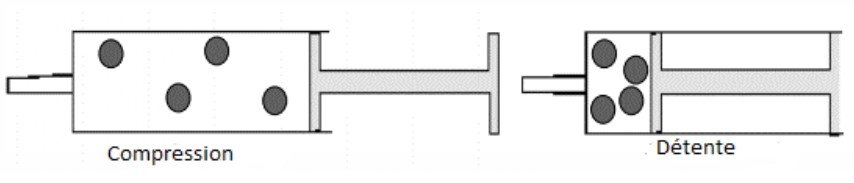
1- Propriétés d’un GAZ
LE gaz est un corps invisible Il occupe tout l’espace qui lui est offert en changeant de forme et de volume : il est compressible et expansible. On ne peut le saisir à la main.
2- Modèle moléculaire des liquides
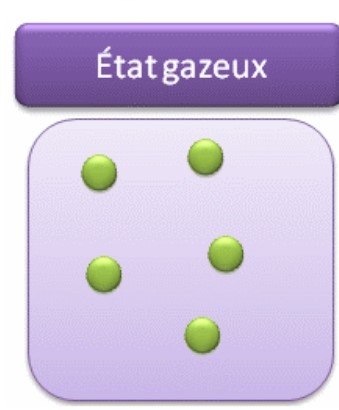
Les particules d’un gaz sont éloignées les unes des autres et très agitées. Elles se déplacent dans tous les sens à grande vitesse. Les particules ne sont pas liées. L’état gazeux est dispersé et très désordonné.
Voir aussi