Les lois fondamentales qui régissent les réactions chimiques, également appelées lois de la réaction chimique, sont des principes clés qui décrivent comment la matière se transforme lorsqu’elle participe à des réactions chimiques.
Les lois de la réaction chimique
« Rien ne se perd, rien ne se crée, tout se transforme » Antoine Laurent de Lavoisier, né le 26 aout à paris.
I- Conservation de la masse lors d’une transformation chimique
La masse se conserve-t-elle au cours d’une transformation chimique ?
1- Loi de conservation de masse
a- Expérience
On pèse 4g de soufre (jaune) et 7g de poudre de fer (gris). Après on chauffe le mélange jusqu’à l’incandescence à l’aide du bec Bensun.
 Le fer réagit avec le soufre pour former du sulfure de fer.
Le fer réagit avec le soufre pour former du sulfure de fer.

A la fin de la réaction. On mesure la masse du produit :
b- Observation
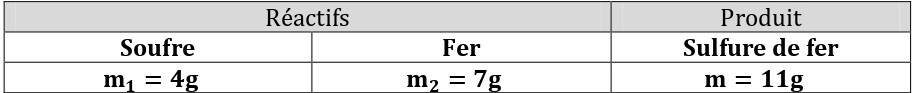 La masse du produit (sulfure de fer) est égale à la somme des masses des réactifs ( soufre et fer). On dit que la masse à été conservée.
La masse du produit (sulfure de fer) est égale à la somme des masses des réactifs ( soufre et fer). On dit que la masse à été conservée.
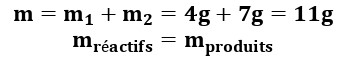
c- Conclusion
Au cours d’une transformation chimique, la masse des réactifs qui disparaissent est égale à la masse des produits qui se forment : il y a conservation de la masse.
II- Loi de conservation des atomes en genre et en nombre
1- Combustion du carbone dans le dioxygène
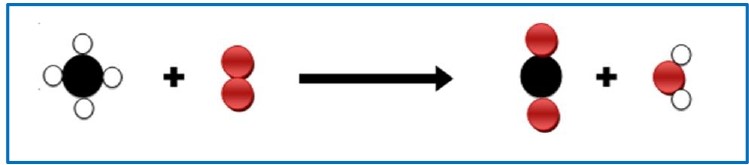
Un atome de carbone réagit avec une molécule de dioxygène pour former une molécule de dioxyde carbone.
Bilan de réaction du carbone avec le dioxygène s’écrit sous la forme suivante :
Carbone + Dioxygème → Dioxyde de carbone
A partir du modèle atomique et moléculaire, on représente les réactifs et le produit de la combustion du carbone par des sphères colorées :

b- Observation
Dans les réactifs, il y a une sphère noire (un atome de carbone) et deux sphères rouges(2 atomes d’oxygène). Dans le produit, il y a également une sphère noire (un atome de carbone) et deux rouges (2 atomes d’oxygène).
Les atomes présents dans les réactifs se réarrangent pour former les produits.
Les molécules ne sont pas conservées.
c- Conclusion
Au cours d’une réaction chimique, les atomes présents dans les réactifs sont identiques en genre et en nombre aux atomes présents dans les produits : il y a conservation des atomes en genre et en nombre.
III- Ecriture de l’équation chimique
1- Exemple : combustion du carbone dans le dioxygène
Bilan de réaction du carbone avec le dioxygène s’écrit sous la forme suivante :
Carbone + Dioxygème → Dioxyde de carbone
En utilisant les symboles atomiques et les formules moléculaires, on écrit l’équation chimique
C + O2 → CO2
2- conclusion
La réaction chimique est représentée au niveau atomique par une équation chimique appelée équation de réaction chimique.
On écrit l’équation de la réaction chimique en mettant à gauche les symboles ou les formules chimiques des réactifs séparés par un signe (+) , et à droite les symboles ou les formules chimiques des produits aussi séparés par un signe (+) , on sépare entre les réactifs et les produits par une flèche indiquant le sens de la réaction chimiqe.
IV- Comment équilibrer une équation chimique ?
1- Exemple : combustion complète du méthane
La combustion complète du méthane produit du dioxyde de carbone et de l’eau.
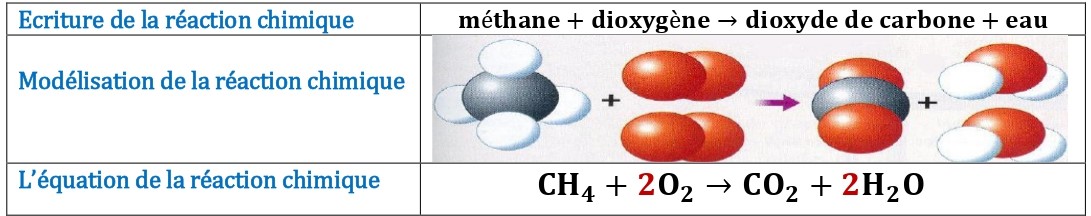
Ecriture de la réaction chimique en utilisant les noms des réactifs et des produits :
Méthane + Dioxygème → Eau + Dioxyde de carbone
Modélisation de la réaction chimique en utilisant les modèles moléculaires :
L’équation de la réaction chimique :
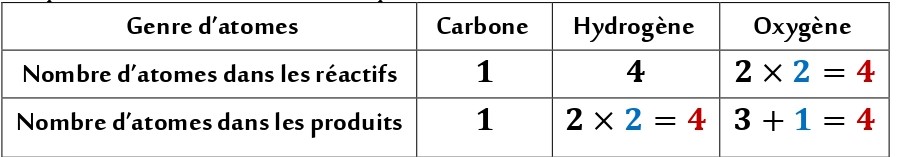
On compte le nombre d’atomes de chaque type dans les réactifs et dans les produits :
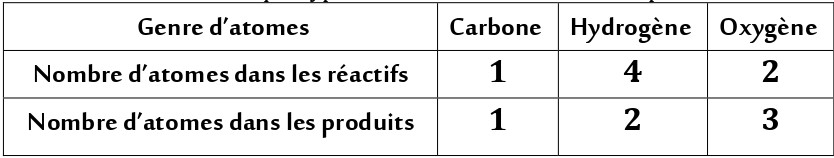
Il y a conservation d’atomes en genre et non conservation d’atomes en nombre.
L’équation n’est pas équilibrée.
On équilibre l’équation de cette réaction chimique :
1 molécule de méthane réagit avec 2 molécules de dioxygène pour former molécule de dioxyde de carbone et molécules d’eau.
Bilan :
2- conclusion
En appliquant la loi de conservation des atomes en genre et en nombre, on équilibre l’équation de réaction chimique.
pour équilibrer l’équation de réaction, on place devant les symboles et les formules chimiques des réactifs et des produits, des nombres entiers. Ces nombres est appelés coefficients stoechiométriques.
Remarque : Lorsque le coefficient est le chiffre 1, il n’est pas écrit.
Voir aussi
