Quelques propriétés de l’air et ses constituants exercices corrigés
Quelques propriétés de l’air et ses constituants
I- Compressibilité, expansibilité et pression d’un gaz:
$\checkmark$ Expériences:
On peut par exemple réaliser une compression avec une seringue bouchée, dont l’air ne peut ni sortir ni rentrer et où sa quantité reste donc constante.
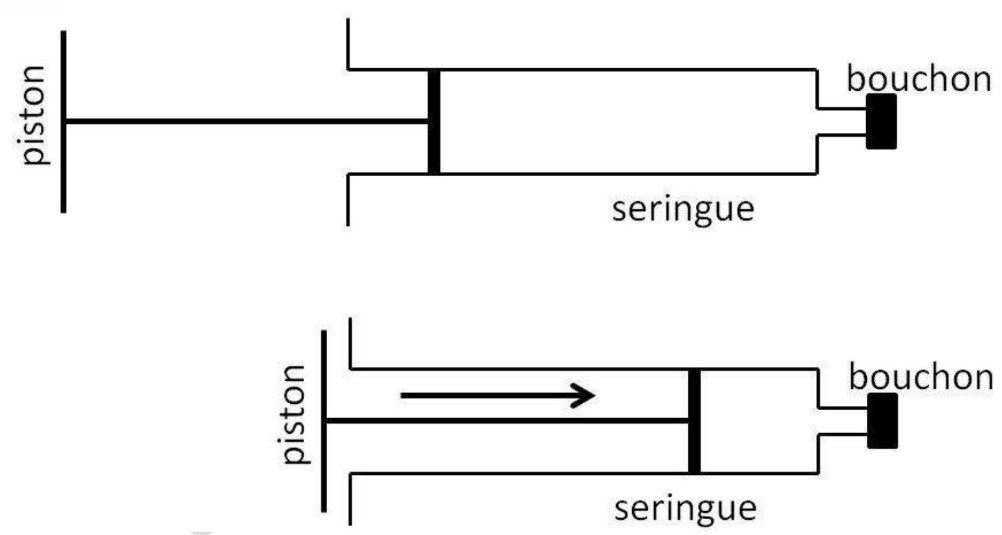
– Si on appuie sur le piston le volume occupé par l’air diminue : cette opération est donc une compression.
– Pendant cette compression, plus on appuie sur le piston, plus il est difficile de maintenir le doigt sur l’extrémité de la seringue et d’appuyer sur le piston. Cela signifie que l’air dans la seringue pousse de plus en plus sur le piston : sa pression augmente.
On peut, par exemple réaliser une expansion en tirant sur le piston d’une seringue bouchée.
– Le volume occupé par l’air augmente bien.
– Pendant cette expansion, plus on tire sur le piston, plus le piston est aspiré par la seringue. Cela signifie que l’air dans la seringue pousse moins que l’air de l’extérieur de la seringue : sa pression diminue.
$\checkmark$ Remarque:
– Lors d’une compression la pression d’un gaz augmente d’autant plus que son volume diminue.
– Lors d’une expansion la pression d’un gaz diminue d’autant plus que son volume augmente.
Cela signifie que le volume et la pression d’une masse constante de gaz varient en sens inverse. (a température constante)
$\checkmark$ Résumé :
L’air (et les gaz en général) sont compressibles et expansibles.
II- l’air a une masse :
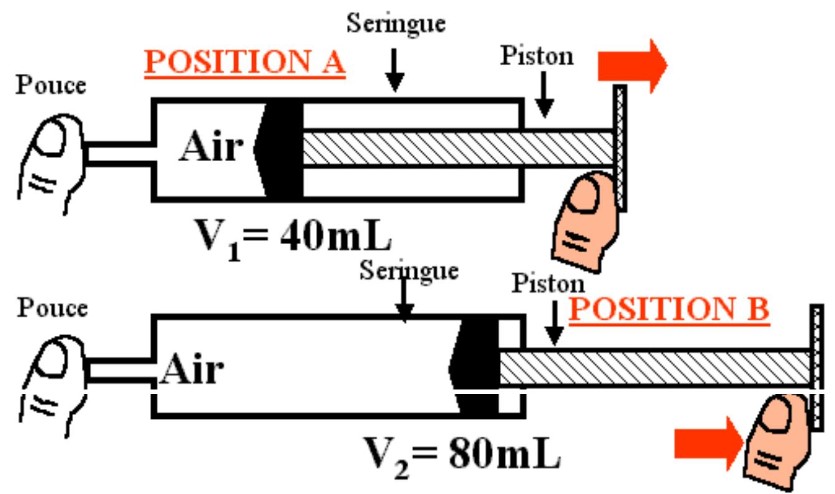
$\checkmark$ Expérience :
– Pour mesurer la masse d’un litre d’air on peut par exemple retirer un litre air d’un ballon. Ce litre d’air peu être retiré par déplacement d’eau en transférant l’air dans un récipient de contenant un litre d’eau.
– La différence de masse entre le ballon gonflé et le ballon dégonflé permet de calculer la masse du litre d’air retiré de ce ballon.
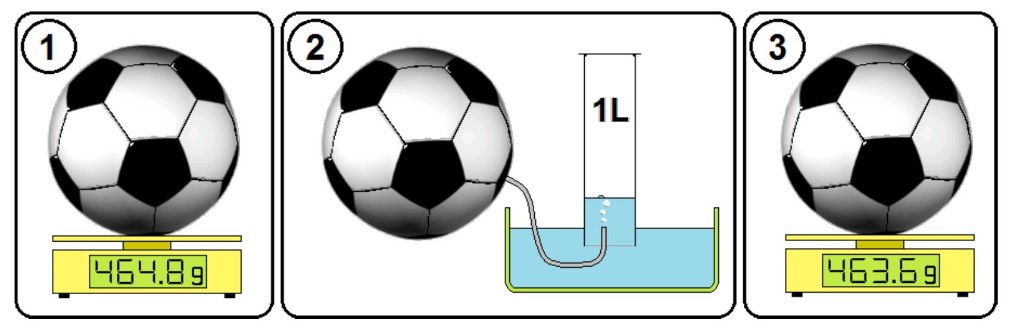
$\mathrm{m}=\mathrm{m_1} -\mathrm{m_2}$
$ \mathrm{m}=464.8 \mathrm{~g}-463.6 \mathrm{~g}=1.3 \mathrm{~g}$
$\checkmark$ Résumé :
La masse d’un litre d’air est de l’ordre de $1 g$ dans des conditions habituelles.
Plus précisément, à $20^{\circ} \mathrm{C}$ et sous une pression de 1013 hPa , la masse d’un litre d’air est de $1,29 \mathrm{~g}$.
III- Constituants de l’air :
$\checkmark$ Expérience :
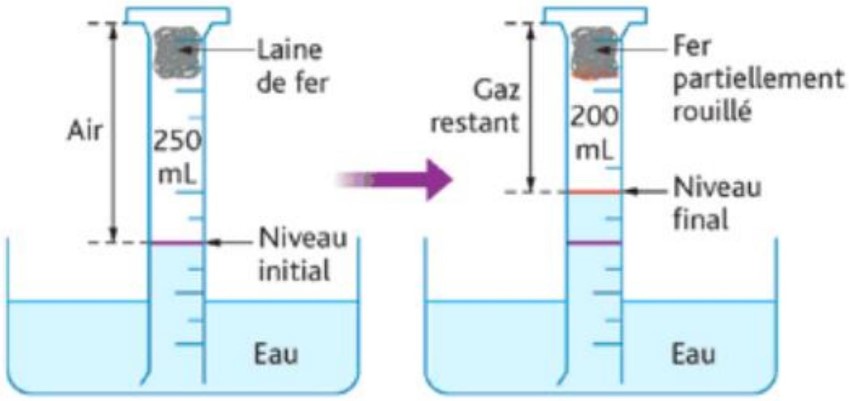
$\checkmark$ Résultat:
Après de quelques jours du début de l’expérience on constate que :
– Une partie de la laine de fer est transformée en rouille.
– Le volume du gaz qui a disparu (dioxygène) est V= $250-200=50 \mathrm{~mL}$, c’est le gaz qui a transformé la laine de fer en rouille.
– L’air est un mélange de plusieurs gaz , il est constitué essentiellement de deux corps purs : le dioxygène qui représente $20 \%$ ou $\frac{1}{5}$ du volume de l’air et le diazote qui représente $80 \%$ ou $\frac{4}{5}$ du volume de l’air.
$\checkmark$ Remarque:
L’air contient d’autres gaz en faible quantité : le dioxyde de carbone, la vapeur d’eau …
Exercice 1:
Choisir la bonne réponse
$1)$ L’air contient environ quatre fois plus / quatre fois moins de dioxygène que de diazote.
$2)$ L’air contient $78 \%$ de dioxygène / de diazote.
$3)$ Quand on tire le piston le volume augmente / diminue et la pression augmente /diminue.
$4)$ L’air contient environ $1 \%$ de dioxygène / d’autres gaz / de diazote.
$5)$ On peut mesurer la pression dans la seringue grâce à un manomètre / thermomètre.
$6)$ Dans les conditions normales de température et de pression, la masse d’un litre d’air est de $1,29 \mathrm{~g}$ / $1,9 \mathrm{~g}$
$1)$ L’air contient environ quatre fois moins de dioxygène que de diazote.
$2)$ L’air contient $78 \%$ de diazote.
$3)$ Quand on tire le piston le volume augmente et la pression diminue.
$4)$ L’air contient environ $1 \%$ d’autres gaz .
$5)$ On peut mesurer la pression dans la seringue grâce à un manomètre.
$6)$ $1,29 \mathrm{~g}$
Exercice 2:
Placer les mots suivants dans la bonne place : Diazote – gaz – dioxygène – $1,3 \mathrm{~g}$ – manomètre – pascal – mélange – dioxygène
– L’air est un$……………….$constitué principalement de deux $……………….$
– L’air contient environ $80 \%$ de$……………….$et $20 \%$ de$……………….$ .
– Le gaz indispensable à la vie est le$……………….$ .
– Dans les conditions normales de température et de pression, la masse d’un litre d’air est de $……………….$
– La pression d’un gaz se mesure avec un $……………….$ . L’unité de mesure de la pression est le $……………….$
Exercice 3:
On tire sur le piston d’une seringue bouchée
$1)$ L’air contenu dans la seringue subit-il une compression ou une expansion (détente) ?
$2)$ Y a-t-il variation:
$a)$ Du volume de l’air emprisonné ?
$b)$ De sa pression ?
$c)$ De sa masse ?
Exercice 4:
On enferme de l’air dans une seringue, puis on pousse le piston.
$1)$ Compléter les phrases avec les verbes « augmenter » ou « diminuer ».
$a)$ Le volume de l’air enfermé …………………………
$b)$Les distances entre les molécules à l’intérieur de la seringue……………………………
$c)$ La pression de l’air dans la seringue…………………….
$2)$ Sachant que la seringue contient $200$ molécules des gaz majoritaires, calculer/estimer le nombre de molécules de dioxygène et le nombre de molécules de diazote.
Exercice 5:
A l’aide d’un ballon, d’une balance électronique, d’une aiguille et d’un tube souple, on réalise les expériences ci- contre :
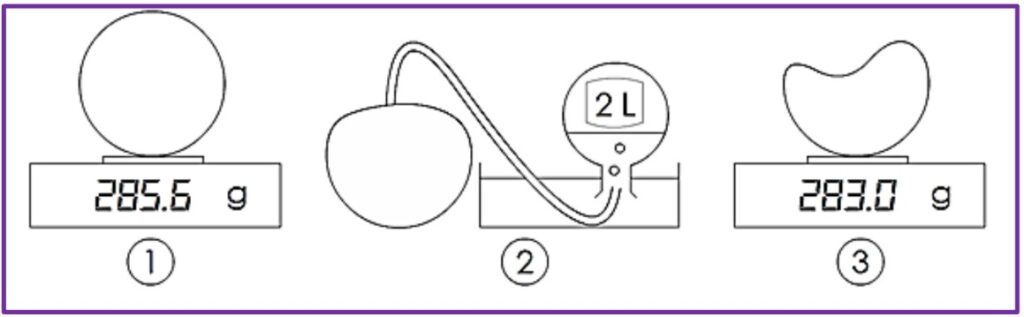
$1$ : le ballon gonflé est pesé $\mathrm{m_1}=285.6\mathrm{~g}$
$2$ : On prélève/retire deux litres d’air $\mathrm{V}=2\mathrm{~L}$
$3$ : le ballon est pesé à nouveau $\mathrm{m_2}=283.0\mathrm{~g}$
$1)$ Calculer la masse de deux litres $2\mathrm{~L}$ d’air.
$2)$ En déduire la masse d’un litre $1\mathrm{~L}$ d’air.
Exercice 6:
$1)$ La pression de l’air enfermé dans une seringue est mesurée avec un manomètre. Le manomètre indique $1000 hPa$. Lorsque l’on déplace le piston, le manomètre indique $1100 hPa$.
$a)$ Le piston a-t-il été poussé ou tiré ?
$b)$ Que peut-on conclure ?
$2)$ Une salle a pour dimensions : $10,5 m × 8m × 3m$
$a)$ Calculer le volume d’air contenu dans la salle en mètre cube et en litre.
$b)$ Calculer la masse d’air contenu dans la salle.
$c)$ Calculer le volume de dioxygène contenu dans la sale.
Exercice 7:
Une piscine gonflable contient $2300 L$ d’air.
$1)$ Citer les deux constituants majoritaires de l’air.
$2)$ Donner les proportions de chacun de ces deux gaz.
$3)$ Rappeler quelle est la masse d’un litre d’air dans les conditions usuelles.
$4)$ Calculer la masse d’air contenu dans cette piscine.
Exercice 8:
Pour rouler en toute sécurité, il est important que la pression des pneus de la voiture soit vérifiée régulièrement. Le garagiste mesure alors la pression du pneu puis ajoute de l’air.

$1)$ Quel appareil de mesure utilise-t-il pour mesurer la pression du pneu ?
$2)$ Comment varie la masse d’air dans le pneu lorsqu’on le gonfle ?
$3)$ Comment varie la pression du pneu lors de son gonflage ?
$4)$ Quelle propriété de l’air et des gaz en général met-on en évidence lorsqu’on gonfle un pneu ?
Exercice 9:
En utilisant le schéma ci-dessus, réponds aux questions suivantes :
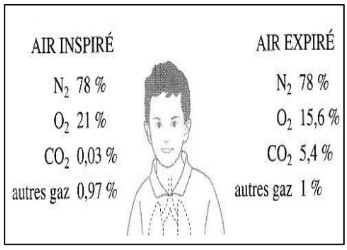
$1)$ L’air que tu expires a-t-il la même composition que l’air que tu inspires ?
$2)$ Quel est le gaz qui a été consommé ? Quel est le gaz qui est principalement rejeté ?
$3)$ Une salle de classe dans laquelle se sont déroulés plusieurs cours consécutifs doit être aérée en ouvrant les fenêtres. Pourquoi faut-il prendre cette précaution ?
Exercice 10:
On pose sur une bougie allumée dans un récipient pleine d’eau colorée une
éprouvette, après quelque instant on observé la bougie s’éteint .
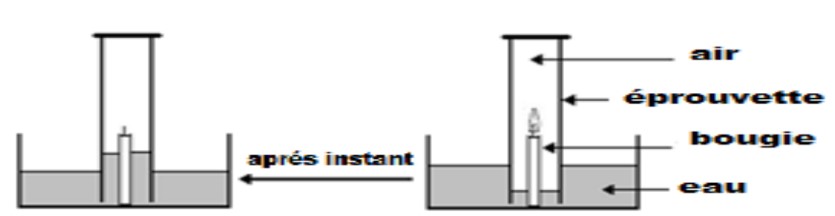
$1)$ Quel sont les gazes dans l’éprouvette au début de l’expérience ?
$2)$ Comment expliquez-vous la montée d’eau dans l’éprouvette?
Exercice 11:
On pèse une bouteille d’air comprimé, on trouve une masse de $21.8 \mathrm{~Kg}$ .
on utilise la bouteille quelque temps puis on la pèse à nouveau ,on trouve alors $20 \mathrm{~Kg}$ .
Sachant que 1 litre d’air dans les conditions usuelles a une masse de $1.3 \mathrm{~g}$ .
Quel est le volume d’air qui a été utilisé ?
Quelques propriétés de l’air et ses constituants exercices corrigés
